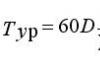Mga resulta ng paghahanap para sa \"stable elements\". Synthesis ng superheavy elements
Isinagawa ang gawain sa Laboratory of Nuclear Reactions (NLNR) na pinangalanan. G.N. Flerov ng Dubna Joint Institute for Nuclear Research (JINR) na matagumpay. Ang mga pag-aari ng ika-117 at mga elemento ng N 112-116 at 118 na dati nang na-synthesize sa Dubna ay direktang katibayan ng pagkakaroon ng tinatawag na "isla ng katatagan" napakabigat na elemento, hinulaan ng mga teorista noong dekada 60 ng huling siglo at makabuluhang pinalawak ang mga limitasyon ng periodic table. Ang mga editor ng Izvestia ay ipinaalam tungkol sa natatanging eksperimento noong Marso ng pinuno ng FLNR, Academician Yuri Oganesyan, ngunit nagbigay lamang siya ng pahintulot para sa paglalathala ngayon. Ang may-akda ng pagtuklas, si Academician Yuri Oganesyan, ay nagsabi sa tagamasid na si Pyotr Obraztsov tungkol sa kakanyahan ng eksperimento.
Izvestia: Ano ang naging sanhi ng interes ng mga siyentipiko sa synthesis ng mga superheavy na elemento, na umiiral para sa isang hindi gaanong kaunting panahon?
Yuri Oganesyan: Matapos ang pagtuklas ng mga unang artipisyal na elemento - neptunium at plutonium - noong 1940-1941, ang tanong ng mga limitasyon ng pagkakaroon ng mga elemento ay naging lubhang kawili-wili para sa pangunahing agham ng istraktura ng bagay. Sa pagtatapos ng huling siglo, 17 artipisyal na elemento ang natuklasan at ang kanilang nuklear na katatagan ay natagpuang bumaba nang husto sa pagtaas ng atomic number. Kapag lumipat mula sa ika-92 na elemento - uranium - hanggang sa ika-102 na elemento - Nobelium, ang kalahating buhay ng nucleus ay bumababa ng 16 na order ng magnitude: mula 4.5 bilyong taon hanggang ilang segundo. Samakatuwid, pinaniniwalaan na ang pagsulong sa rehiyon ng mas mabibigat na elemento ay hahantong sa limitasyon ng kanilang pag-iral, na mahalagang minarkahan ang hangganan ng pagkakaroon ng materyal na mundo. Gayunpaman, noong kalagitnaan ng 60s, ang mga teorista ay hindi inaasahang naglagay ng isang hypothesis tungkol sa posibleng pagkakaroon ng superheavy atomic nuclei. Ayon sa mga kalkulasyon, ang buhay ng nuclei na may mga atomic number na 110-120 ay dapat na tumaas nang malaki habang ang bilang ng mga neutron sa mga ito ay tumaas. Ayon sa mga bagong ideya, bumubuo sila ng isang malawak na "isla ng katatagan" ng mga napakabigat na elemento, na makabuluhang nagpapalawak ng mga hangganan ng talahanayan ng mga elemento.
at: Posible bang kumpirmahin ito sa eksperimentong paraan?
Oganesyan: Noong 1975-1996, ang mga physicist mula sa Dubna, Darmstadt (GSI, Germany), Tokyo (RIKEN) at Berkeley (LBNL, USA) ay nagawang pag-aralan ang mga reaksyong ito at mag-synthesize ng anim na bagong elemento. Ang pinakamabibigat na elemento 109-112 ay nakuha sa unang pagkakataon sa GSI at naulit sa RIKEN. Ngunit ang kalahating buhay ng pinakamabibigat na nuclei na ginawa sa mga reaksyong ito ay sampu-sa-libo o kahit isang-libo ng isang segundo. Ang hypothesis tungkol sa pagkakaroon ng mga superheavy na elemento ay unang nakumpirma sa eksperimento sa Dubna, sa pananaliksik na isinagawa ng aming grupo sa pakikipagtulungan ng mga siyentipiko mula sa National Laboratory. Lawrence Livermore (USA). Nagawa naming radikal na baguhin ang diskarte sa synthesis ng superheavy nuclei, halimbawa, sa pamamagitan ng pagpapaputok sa isang target na gawa sa artificial element berkelium (N 97) na may projectile beam mula sa isang napakabihirang at mahal na calcium isotope (N 20) na may isang mass ng 48. Kapag ang nuclei ay pinagsama, elemento N 117 (97 + 20 = 117). Ang mga resulta ay lumampas kahit na ang pinaka-maaasahan na mga inaasahan. Noong 2000-2004, halos sa loob ng limang taon, ito ay sa mga naturang reaksyon na ang mga superheavy na elemento na may atomic number na 114, 116 at 118 ay na-synthesize sa unang pagkakataon.
at: Ano nga ba ang kontribusyong siyentipiko na ginawa ng mga siyentipikong Amerikano?
Oganesyan: Sa isang nuclear reaction na may calcium beam, ang element 117 ay makukuha lamang gamit ang isang target na gawa sa artificial element berkelium. Ang kalahating buhay ng isotope na ito ay 320 araw lamang. Dahil sa maikling buhay, ang produksyon ng berkelium sa kinakailangang halaga (20-30 milligrams) ay dapat isagawa sa isang reaktor na may napakataas na neutron flux density. Tanging ang isotope reactor sa US National Laboratory sa Oak Ridge ang makakahawak ng ganoong gawain. Sa pamamagitan ng paraan, ito ay sa laboratoryo na ang plutonium ay unang ginawa para sa mga Amerikano bomba atomika. Dahil mula sa sandali ng paggawa ng berkelium ang dami nito ay bumababa ng kalahati pagkatapos ng 320 araw, kinakailangan na isagawa ang lahat ng trabaho sa isang mataas na bilis. At hindi lamang sa mga laboratoryo, kundi pati na rin sa mga opisyal na istruktura sa Russia at Estados Unidos na may kaugnayan sa sertipikasyon ng hindi pangkaraniwang materyal, transportasyon ng isang mataas na radioactive na produkto sa pamamagitan ng lupa at hangin, mga pag-iingat sa kaligtasan, at iba pa.
at: Karapat-dapat sa isang kuwento ng pakikipagsapalaran. Ano ang sumunod na nangyari?
Oganesyan: Sa simula ng Hunyo 2009, dumating ang lalagyan sa Moscow. Mula sa sangkap na ito, isang target ang ginawa sa Research Institute of Nuclear Reactors (Dimitrovgrad) sa anyo ng isang manipis na layer ng berkelium (300 nanometer) na idineposito sa manipis na titanium foil; noong Hulyo ang target ay naihatid sa Dubna. Sa puntong ito, lahat sa FLNR gawaing paghahanda ay nakumpleto, at ang tuluy-tuloy na pag-iilaw ng target na may matinding calcium beam ay nagsimula. Nasa unang pag-iilaw ng target sa loob ng 70 araw, masuwerte kami: naitala ng mga detector ang pagbuo at pagkabulok ng nuclei ng ika-117 na elemento ng limang beses. Tulad ng inaasahan, ang nuclei ng elementong ito ay nabago sa nuclei ng elemento 115, ang elemento 115 ay nabago sa elemento 113, at pagkatapos ang elemento 113 ay nabago sa elemento 111. At ang elemento 111 ay nabulok na may kalahating buhay na 26 segundo. Sa isang nuclear scale, ito ay isang malaking oras! Ngayon ang periodic table ay napunan na ng isa pa sa pinakamabibigat na elemento na may atomic number na 117.
at: Ang aming mga mambabasa ay natural na magiging interesado sa kung ano praktikal na gamit maaaring magkaroon ng iyong natuklasan.
Oganesyan: Ngayon, siyempre, wala, dahil iilan lamang ang mga atomo ng elementong N 117. Mula sa isang pundamental na pananaw, ang mga ideya tungkol sa ating mundo ay dapat na ngayong magbago nang malaki. Bukod dito, kung ang mga elemento na may malaking kalahating buhay ay na-synthesize, kung gayon posible na sila ay umiiral sa kalikasan at maaaring "mabuhay" hanggang sa ating panahon mula noong nabuo ang Earth - 4.5 bilyong taon. At nagsasagawa kami ng mga eksperimento upang hanapin ang mga ito; ang aming pag-install ay matatagpuan sa kailaliman ng mga bundok ng Alpine.
at: Isang tanong mula sa ibang eroplano. Sa iyong palagay, bakit mayroon ang mga halatang tagumpay sa nuclear physics mga nakaraang taon 20 ay hindi kailanman ginawaran ng Nobel Prize?
Oganesyan: Malaki ang Physics. Tila, ang mga miyembro ng Komite ng Nobel ay mas interesado sa iba pang mga lugar ng agham na ito. At mayroon talagang maraming karapat-dapat na mga siyentipiko. Siyanga pala, dapat kong pangalanan ang mga kalahok sa aming eksperimento: Oak Ridge National Laboratory (Prof. James Roberto), Unibersidad. Vanderbilt (Prof. Joseph Hamilton), National Laboratory. Lawrence Livermore (Dawn Shaughnessy), Research Institute of Nuclear Reactors, Dimitrovgrad (Mikhail Ryabinin) at ang Laboratory of Nuclear Reactions ng JINR (head Yuri Oganesyan).
Mula sa editor. Pansamantala, ang elementong N 117 ay tatawaging “one-one-seven” sa Latin, iyon ay, ununseptium. Ang pangkat ng akademya na si Yuri Oganesyan - ang mga may-akda ng pagtuklas - ay may karapatan na magbigay ng tunay na pangalan sa elementong ito, gayundin ang mga elementong N 114-116 at 118 na natuklasan nila. Sa "Linggo" ng Marso 26, inanyayahan namin ang mga mambabasa na isumite ang kanilang mga panukala para sa pangalan ng "aming" mga elemento. Sa ngayon, ang "kulot" lamang para sa isa sa mga elementong ito ay tila makatwiran. Patuloy ang kompetisyon.
Ang iba ay nahulog at hindi nakaligtas hanggang ngayon. Ang uranium ay nabubulok pa rin - ito ay isang radioactive na elemento.
Ang lahat ng mga elemento pagkatapos ng uranium ay mas mabigat kaysa dito. Nabuo ang mga ito nang isang beses sa panahon ng proseso ng nucleosynthesis (isang proseso kung saan ang nuclei ng kumplikado, mabibigat na elemento ng kemikal ay nabuo mula sa mas simple at mas magaan na atomic nuclei), ngunit hindi nakaligtas hanggang sa araw na ito. Ngayon ay maaari lamang silang makuha sa artipisyal na paraan.
Ang pagtuklas noong 1940-1941 ng mga unang artipisyal na elemento, neptunium at plutonium, ay ang simula ng isang bagong direksyon sa nuclear physics at chemistry upang pag-aralan ang mga katangian ng mga elemento ng transuranic at ang kanilang aplikasyon sa maraming larangan ng agham at teknolohiya. Bilang resulta ng maraming taon ng masinsinang trabaho, ang mga nuclear physicist ay nag-synthesize ng ilang bagong elemento.
Mayroong tatlong internasyonal na kinikilalang sentro ng pananaliksik para sa synthesis ng mabibigat na elemento: sa Dubna (Russia), sa Berkeley (USA) at sa Darmstadt (Germany). Ang lahat ng mga bagong elemento, simula sa ika-93 (neptunium), ay nakuha sa mga laboratoryo na ito. Ang isang bagong elemento ay hindi itinuturing na natuklasan hanggang ang isang grupo ng mga mananaliksik ay nakakakuha ng maaasahang mga resulta mula sa pag-aaral ng mga atomo nito at hanggang sa isa pang (independiyenteng) grupo ng mga siyentipiko ay kumpirmahin ang mga resultang ito. Samakatuwid, ang malalayong mga cell ng Periodic Table ay napupuno nang napakabagal.
Noong 1940 - 1953, si Propesor Glen Seaborg at ang kanyang mga kasamahan sa Radiation National Laboratory (Berkeley, USA) ay nag-synthesize ng mga artipisyal na elemento na may Z = 93 - 100. Nakuha ang mga ito sa mga reaksyon ng sunud-sunod na pagkuha ng mga neutron sa pamamagitan ng nuclei ng uranium isotope - 235U sa pangmatagalang irradiation at malakas mga nuclear reactor. Ang lahat ng mas mabibigat na nuclei ay nakuha sa mga sisingilin na particle accelerators, kung saan ang nuclei at mga particle na pinabilis sa mataas na bilis ay nagbanggaan. Bilang resulta ng mga banggaan, ang nuclei ng mga superheavy na elemento ay nabuo, na umiiral nang napaka maikling panahon, at pagkatapos ay maghiwa-hiwalay muli. Salamat sa mga bakas ng pagkabulok na ito, natukoy na ang synthesis ng isang mabigat na nucleus ay matagumpay.
Ang mga elementong mas mabigat kaysa sa Z=100 ay na-synthesize sa mga reaksyon na may pinabilis na mabibigat na ion, kapag ang isang complex ng mga proton at neutron ay ipinakilala sa target na nucleus. Mula noong 1960s, ang panahon ng elementarya na particle accelerators - cyclotrons, ang panahon ng acceleration ng heavy ions ay nagsimula, nang ang synthesis ng mga bagong elemento ay nagsimulang isagawa lamang sa pamamagitan ng pakikipag-ugnayan ng dalawang mabibigat na nuclei. Gayunpaman, noong kalagitnaan ng 1970s, halos imposibleng pag-aralan ang mga kemikal na katangian ng mga elemento 104, 105, 106 at 107, dahil ang kanilang buhay - mga fraction ng isang microsecond - ay hindi pinapayagan para sa ganap na pananaliksik sa kemikal. Lahat ng mga ito ay na-synthesize sa malamig na pagsasanib ng mga reaksyon (ang malamig na pagsasanib ng napakalaking nuclei ay natuklasan noong 1974; naglalabas ito ng isa o dalawang neutron na may medyo mababang enerhiya.)
Ang Element 104 ay unang na-synthesize sa Dubna noong 1964. Natanggap ito ng isang pangkat ng mga siyentipiko mula sa Laboratory of Nuclear Reactions na pinamumunuan ni Georgy Flerov. Noong 1969, ang elemento ay nakuha ng isang grupo ng mga siyentipiko sa Unibersidad ng Berkeley, California. Noong 1997, ang elemento ay pinangalanang rutherfordium, simbolo ng Rf.
Ang Element 105 ay na-synthesize noong 1970 ng dalawang independiyenteng grupo ng mga mananaliksik sa Dubna (USSR) at Berkeley (USA). Pinangalanan itong dubnium bilang parangal sa lungsod ng Dubna, kung saan matatagpuan ang Joint Institute for Nuclear Research, kung saan na-synthesize ang ilang elemento ng kemikal, simbolo ng Db.
Ang Element 106 ay unang nakuha sa USSR ni Georgy Flerov at ng kanyang mga kasamahan noong 1974, at halos sabay-sabay na ito ay na-synthesize sa USA ni Glen Seaborg at ng kanyang mga kasamahan. Noong 1997, inaprubahan ng International Union of Pure and Applied Chemistry (IUPAC) ang pangalang seaborgium (bilang parangal sa Seaborg) para sa elemento 106, simbolo na Sg.
Ang mga malamig na reaksyon ng pagsasanib ng napakalaking nuclei ay matagumpay na ginamit upang synthesize ang anim na bagong elemento, 107 hanggang 112, sa GSI National Nuclear Physics Center sa Darmstadt, Germany. Ang mga unang eksperimento upang makakuha ng elemento 107 ay isinagawa sa USSR ni Yuri Oganesyan at ng kanyang mga kasamahan noong 1976. Ang unang maaasahang impormasyon tungkol sa mga nuklear na katangian ng elemento 107 ay nakuha sa Alemanya noong 1981 at 1989. Noong 1997, inaprubahan ng IUPAC ang pangalang bohrium para sa elemento 107 (bilang parangal kay Niels Bohr), simbolo na Bh.
Ang mga unang eksperimento upang makakuha ng elemento 108 ay isinagawa sa USSR noong 1983-1984. Ang maaasahang data sa mga katangiang nuklear ng elemento 108 ay nakuha sa Alemanya noong 1984 at 1987. Noong 1997, inaprubahan ng IUPAC ang pangalang Hassium (para sa lupain ng Hesse, Germany), ang simbolo Hs, para sa elemento 108.
Ang Element 109 ay unang nakuha sa Germany noong 1982 at nakumpirma noong 1984. Noong 1994, inaprubahan ng IUPAC ang pangalang meitnerium para sa elemento 109 (pagkatapos ng Lise Meitner), simbolo ng Mt.
Ang Element 110 ay natuklasan noong 1994 sa Heavy Ion Research Center sa Darmstadt (Germany) sa panahon ng isang eksperimento kung saan ang isang espesyal na haluang metal na naglalaman ng tingga ay idineposito sa mga plato at binomba ng mga nickel isotopes. Ang Darmstadtium ay ipinangalan sa lungsod ng Darmstadt (Germany), kung saan ito natuklasan. Simbolo Ds.
Natuklasan din ang Element 111 sa Germany at pinangalanang roentgenium (simbulo ng kemikal na Rg) bilang parangal sa siyentipikong Aleman na si Wilhelm-Conrad Roentgen.
Ang Elemento 112 ay may gumaganang pangalan na "ununbiy" (Uub), na nagmula sa mga Latin na numerong "isa-isa-dalawa". Ito ay isang transuranic na elemento na nakuha sa pamamagitan ng pagbomba sa isang lead target na may zinc nuclei. Ang kalahating buhay nito ay humigit-kumulang 34 segundo.
Unang nakuha ang Ununbium noong Pebrero 1996 sa heavy ion accelerator sa Darmstadt. Upang makakuha ng mga atom ng bagong elemento, ang pangkat ng mga siyentipiko ay gumamit ng mga zinc ions na may atomic number 30, na pinabilis sa napakataas na enerhiya sa isang 120-meter accelerator, pagkatapos nito ay natamaan nila ang isang target na gawa sa tingga, na ang atomic number ay 82. Kapag ang zinc at lead nuclei ay pinagsama, ang pagbuo ay naganap nuclei ng isang bagong elemento, ang atomic number nito ay katumbas ng kabuuan ng atomic number ng mga orihinal na bahagi. Noong Hunyo 2009, opisyal na kinilala ng IUPAC ang pagkakaroon nito.
Mas mabibigat na elemento - na may mga atomic number na 112-116 at ang pinakamabigat sa sa sandaling ito Element 118 - ay nakuha ng mga Russian scientist mula sa Joint Institute for Nuclear Research sa Dubna noong 2000-2008, ngunit naghihintay pa rin ng opisyal na pagkilala ng IUPAC.
Sa kasalukuyan, ang mga physicist ng Russia mula sa Flerov Laboratory ng Joint Institute for Nuclear Research sa Dubna ay nagsasagawa ng isang eksperimento sa synthesis ng ika-117 elemento, na ang lugar sa periodic table sa pagitan ng dating nakuha na ika-116 at ika-118 na elemento ay wala pa ring laman.
Una, isang artikulo tungkol sa kung ano ang "isla ng katatagan".
Isla ng katatagan: Ang mga siyentipikong nuklear ng Russia ay nangunguna sa karera
Ang synthesis ng mga superheavy na elemento na bumubuo sa tinatawag na "isla ng katatagan" ay isang ambisyosong gawain ng modernong pisika, sa paglutas kung aling mga siyentipikong Ruso ang nangunguna sa buong mundo.
Noong Hunyo 3, 2011, opisyal na kinilala ng isang ekspertong komisyon, na kinabibilangan ng mga espesyalista mula sa International Unions of Pure and Applied Chemistry (IUPAC) and Physics (IUPAP), ang pagtuklas ng ika-114 at ika-116 na elemento ng periodic table. Ang priyoridad ng pagtuklas ay ibinigay sa isang grupo ng mga physicist na pinamumunuan ng Academician ng Russian Academy of Sciences na si Yuri Oganesyan mula sa Joint Institute for Nuclear Research sa tulong ng mga kasamahan sa Amerika mula sa Livermore National Laboratory. Lawrence.

RAS Academician Yuri Oganesyan, Pinuno ng Laboratory of Nuclear Reactions sa JINR
Ang mga bagong elemento ay naging pinakamabigat sa mga kasama sa periodic table, at nakatanggap ng mga pansamantalang pangalan na ununquidium at unungexium, na nabuo ng serial number sa talahanayan. Iminungkahi ng mga physicist ng Russia na pangalanan ang mga elemento bilang "flerovium" bilang parangal kay Georgiy Flerov, isang Soviet nuclear physicist, espesyalista sa larangan ng nuclear fission at synthesis ng mga bagong elemento, at "moscovium" bilang parangal sa rehiyon ng Moscow. Bilang karagdagan sa mga elemento 114 at 116, ang JINR ay na-synthesize dati mga elemento ng kemikal na may mga serial number 104, 113, 115, 117 at 118. At ang ika-105 na elemento ng talahanayan bilang parangal sa pagkilala sa kontribusyon ng mga physicist ng Dubna sa modernong agham ay binigyan ng pangalang "Dubny".
Mga elementong wala sa kalikasan
Sa kasalukuyan, ang buong mundo sa paligid natin ay binubuo ng 83 elemento ng kemikal, mula sa hydrogen (Z=1, Z ang bilang ng mga proton sa nucleus) hanggang sa uranium (Z=92), ang buhay nito ay mas mahaba kaysa sa buhay ng solar. sistema (4.5 bilyong taon) . Ang mas mabibigat na elemento na lumitaw sa panahon ng nucleosynthesis sa ilang sandali pagkatapos ng Big Bang ay nabulok na at hindi pa nabubuhay hanggang ngayon. Ang uranium, na may kalahating buhay na humigit-kumulang 4.5 x 10 8 taon, ay nabubulok at radioactive pa rin. Gayunpaman, sa kalagitnaan ng huling siglo, natutunan ng mga mananaliksik na kumuha ng mga elemento na hindi umiiral sa kalikasan. Ang isang halimbawa ng naturang elemento ay ang plutonium na ginawa sa mga nuclear reactor (Z=94), na ginawa sa daan-daang tonelada at isa sa pinakamakapangyarihang pinagmumulan ng enerhiya. Ang kalahating buhay ng plutonium ay makabuluhang mas maikli kaysa sa uranium, ngunit sapat pa rin upang magmungkahi ng posibilidad ng pagkakaroon ng mas mabibigat na elemento ng kemikal. Ang konsepto ng isang atom na binubuo ng isang nucleus na nagdadala sa loob mismo positibong singil pareho ang bulk at electron orbitals, ay nagmumungkahi ng posibilidad ng pagkakaroon ng mga elemento na may atomic number hanggang Z=170. Ngunit sa katunayan, dahil sa kawalang-tatag ng mga proseso na nagaganap sa core mismo, ang hangganan ng pagkakaroon ng mabibigat na elemento ay nakabalangkas nang mas maaga. Sa kalikasan, ang mga matatag na pormasyon (nuclei ng mga elemento na binubuo ng iba't ibang bilang ng mga proton at neutron) ay nangyayari lamang hanggang sa lead at bismuth, na sinusundan ng isang maliit na peninsula kabilang ang thorium at uranium na matatagpuan sa Earth. Ngunit sa sandaling ang serial number ng isang elemento ay lumampas sa bilang ng uranium, ang buhay nito ay bumababa nang husto. Halimbawa, ang nucleus ng elemento 100 ay 20 beses na hindi gaanong matatag kaysa sa uranium nucleus, at sa hinaharap ang kawalang-tatag na ito ay tumindi lamang dahil sa kusang fission ng nuclei.
"Isla ng Katatagan"
Ang epekto ng spontaneous fission ay ipinaliwanag ni Niels Bohr. Ayon sa kanyang teorya, ang core ay isang patak ng sisingilin na likido, iyon ay, isang uri ng bagay na walang sariling panloob na istraktura. Paano mas dami mga proton sa nucleus, kaya mas malakas na impluwensya Ang mga puwersa ng Coulomb, sa ilalim ng impluwensya kung saan ang patak ay deformed at nahahati sa mga bahagi. Hinuhulaan ng modelong ito ang posibilidad ng pagkakaroon ng mga elemento hanggang sa ika-104 - ika-106 na serial number. Gayunpaman, noong 60s, maraming mga eksperimento ang isinagawa sa Laboratory of Nuclear Reactions ng Joint Institute for Nuclear Research upang pag-aralan ang mga katangian ng fission ng uranium nuclei, ang mga resulta nito ay hindi maipaliwanag gamit ang teorya ni Bohr. Ito ay lumabas na ang nucleus ay hindi isang kumpletong analogue ng isang patak ng sisingilin na likido, ngunit may panloob
istraktura. Bukod dito, ang mas mabigat na nucleus, mas malinaw ang impluwensya ng istrakturang ito, at ang larawan ng pagkabulok ay magiging ganap na naiiba mula sa kung ano ang hinuhulaan ng liquid drop model. Ito ay kung paano lumitaw ang hypothesis tungkol sa pagkakaroon ng isang tiyak na rehiyon ng matatag na superheavy nuclei, malayo sa mga elemento na kilala ngayon. Ang lugar ay tinawag na "isla ng katatagan", at pagkatapos mahulaan ang pagkakaroon nito, ang pinakamalaking mga laboratoryo sa USA, France at Germany ay nagsimula ng isang serye ng mga eksperimento upang kumpirmahin ang teorya. Gayunpaman, ang kanilang mga pagtatangka ay hindi nagtagumpay. At ang mga eksperimento lamang sa Dubna cyclotron, na nagresulta sa pagkatuklas ng ika-114 at ika-116 na elemento, ay posible na igiit na ang rehiyon ng katatagan ng superheavy nuclei ay talagang umiiral.
Ang figure sa ibaba ay nagpapakita ng isang mapa ng mabibigat na nuclides. Ang kalahating buhay ng nuclei ay kinakatawan ng iba't ibang Kulay(kanang sukat). Ang mga itim na parisukat ay isotopes ng mga matatag na elemento na matatagpuan sa crust ng lupa (kalahating buhay higit sa 10 9 taon). Ang madilim na asul na kulay ay ang "dagat ng katatagan", kung saan ang nuclei ay tumatagal ng mas mababa sa 10 −6 segundo. Ang "Mga Isla ng katatagan" kasunod ng "peninsula" ng mga elemento ng thorium, uranium at transuranium ay mga hula ng microscopic nuclear theory. Dalawang nuclei na may atomic number na 112 at 116, na nakuha sa iba't ibang nuclear reactions at ang sunud-sunod na pagkabulok nito, ay nagpapakita kung gaano kalapit ang isa sa mga "isla ng katatagan" sa panahon ng artipisyal na synthesis ng mga superheavy na elemento.

Mapa ng mabibigat na nuclides
Upang ma-synthesize ang isang matatag na mabigat na nucleus, kinakailangan na ipasok ang maraming mga neutron dito hangga't maaari, dahil ang mga neutron ay ang "glue" na humahawak ng mga nucleon sa nucleus. Ang unang ideya ay ang pag-irradiate ng isang tiyak na panimulang materyal na may neutron flux mula sa reaktor. Ngunit gamit ang pamamaraang ito, ang mga siyentipiko ay nakapag-synthesize lamang ng fermium, isang elemento na may atomic number na 100. Bukod dito, sa halip na 60 neutron ang kailangan, 20 lamang ang ipinasok sa nucleus. Ang mga pagtatangka ng mga Amerikanong siyentipiko na mag-synthesize ng mga superheavy na elemento sa proseso ng isang nuclear explosion (esensyal, sa isang malakas na pulsed flow ng neutrons) ay hindi rin nagtagumpay; ang resulta ng kanilang mga eksperimento ay ang parehong fermium isotope. Mula sa sandaling iyon, nagsimulang bumuo ng isa pang paraan ng synthesis - nagbabanggaan ang dalawang mabibigat na nuclei sa pag-asang ang resulta ng kanilang banggaan ay isang nucleus ng kabuuang masa. Upang maisakatuparan ang eksperimento, ang isa sa mga nuclei ay dapat na pabilisin sa bilis na humigit-kumulang 0.1 ang bilis ng liwanag gamit ang isang mabigat na ion accelerator. Ang lahat ng mabibigat na nuclei na nakuha ngayon ay na-synthesize sa ganitong paraan. Tulad ng nabanggit na, ang isla ng katatagan ay matatagpuan sa rehiyon ng neutron-excess superheavy nuclei, kaya ang target at beam nuclei ay dapat ding maglaman ng labis na mga neutron. Mahirap pumili ng mga naturang elemento, dahil halos lahat ng umiiral na mga stable nuclides ay may mahigpit na tinukoy na ratio ng bilang ng mga proton at neutron.
Sa eksperimento sa synthesis ng elemento 114, ang pinakamabigat na isotope ng plutonium na may atomic mass na 244, na ginawa sa isang reactor sa Livermore National Laboratory (USA), at ang calcium-48 bilang isang projectile core ay ginamit bilang target. Ang Calcium-48 ay isang matatag na isotope ng calcium, kung saan ang regular na calcium ay naglalaman lamang ng 0.1%. Inaasahan ng mga eksperimento na gagawing posible ng pagsasaayos na ito na madama ang epekto ng pagtaas ng buhay ng mga superheavy na elemento. Upang maisagawa ang eksperimento, kinakailangan ang isang accelerator na may calcium-48 beam power, sampu-sampung beses na mas malaki kaysa sa lahat ng kilalang accelerators. Sa loob ng limang taon, ang naturang accelerator ay nilikha sa Dubna; ginawa nitong posible na magsagawa ng isang eksperimento nang ilang daang beses na mas tumpak kaysa sa mga eksperimento sa ibang mga bansa sa nakalipas na 25 taon.
Ang pagkakaroon ng pagtanggap ng isang calcium beam ng kinakailangang intensity, ang mga eksperimento ay nag-iilaw sa target ng plutonium. Kung, bilang isang resulta ng pagsasanib ng dalawang nuclei, ang mga atomo ng isang bagong elemento ay nabuo, pagkatapos ay dapat silang lumipad palabas ng target at, kasama ang sinag, patuloy na sumulong. Ngunit dapat silang ihiwalay sa mga calcium ions at iba pang mga produkto ng reaksyon. Ang function na ito ay ginagawa ng separator.

MASHA (Mass Analyzer of Super Heavy Atoms) - pag-install para sa nuclear separation
Recoil nuclei na inilabas mula sa target na layer stop sa isang graphite collector sa lalim na ilang micrometers. Dahil sa mataas na temperatura ng kolektor, nagkakalat sila sa silid ng pinagmulan ng ion, ay inilabas sa plasma, pinabilis ng electric field at sinusuri ng masa. mga magnetic field habang lumilipat ka patungo sa detector. Sa disenyong ito, maaaring matukoy ang masa ng isang atom na may katumpakan na 1/3000. Ang gawain ng detector ay upang matukoy na ang isang mabigat na nucleus ay tumama dito, upang irehistro ang enerhiya, bilis at lokasyon ng paghinto nito nang may mataas na katumpakan.

Diagram ng pagpapatakbo ng separator
Upang subukan ang teorya ng pagkakaroon ng isang "isla ng katatagan," napagmasdan ng mga siyentipiko ang mga produkto ng pagkabulok ng nucleus ng elemento 114. Kung tama ang teorya, ang resultang nuclei ng elemento 114 ay dapat na lumalaban sa kusang fission, at maging alpha radioactive, iyon ay, naglalabas ng alpha particle na binubuo ng dalawang proton at dalawang neutron. Para sa isang reaksyon na kinasasangkutan ng ika-114 na elemento, isang paglipat mula sa ika-114 hanggang ika-112 ay dapat obserbahan. Pagkatapos ang nuclei ng ika-112 ay sumasailalim din sa pagkabulok ng alpha at nagiging nuclei ng ika-110, at iba pa. Bukod dito, ang buhay ng bagong elemento ay dapat na ilang mga order ng magnitude na mas mahaba kaysa sa buhay ng mas magaan na nuclei. Ito ay tiyak na tulad ng mahabang buhay na mga kaganapan, ang pagkakaroon ng kung saan ay hinulaang theoretically, na nakita ng mga physicist ng Dubna. Ito ay isang direktang indikasyon na ang elemento 114 ay nakararanas na ng pagkilos ng mga pwersang istruktura na bumubuo ng isang isla ng katatagan para sa mga superheavy na elemento.

Mga halimbawa ng nabubulok na kadena ng mga elemento 114 at 116
Sa eksperimento sa synthesis ng ika-116 na elemento, isang natatanging sangkap ang ginamit bilang target - curium-248, na nakuha sa isang malakas na reaktor sa Research Institute of Nuclear Reactors sa Dimitrovgrad. Kung hindi, sinundan ng eksperimento ang parehong pattern tulad ng paghahanap para sa ika-114 na elemento. Ang pagmamasid sa kadena ng pagkabulok ng elemento 116 ay nagbigay ng karagdagang katibayan ng pagkakaroon ng elemento 114, sa pagkakataong ito ay nagreresulta mula sa pagkabulok ng isang mas mabigat na "magulang". Sa kaso ng elemento 116, ang pang-eksperimentong data ay nagpakita din ng isang makabuluhang pagtaas sa buhay na may pagtaas ng bilang ng mga neutron sa nucleus. Yan ay modernong pisika Ang synthesis ng mabibigat na elemento ay malapit na sa hangganan ng "isla ng katatagan". Bilang karagdagan, ang mga elemento na may mga atomic number na 108, 109 at 110 na nabuo bilang isang resulta ng pagkabulok ng ika-116 na elemento ay may habang-buhay na mga minuto, na gagawing posible na pag-aralan ang mga kemikal na katangian ng mga sangkap na ito gamit ang mga modernong pamamaraan ng radiochemistry at eksperimento na subukan ang pundamentalidad ng batas ni Mendeleev tungkol sa periodicity mga katangian ng kemikal mga elemento sa talahanayan. May kaugnayan sa mabibigat na elemento, maaari itong ipalagay na ang ika-112 na elemento ay may mga katangian ng cadmium at mercury, at ang ika-114 - lata, tingga, atbp. Malamang na sa tuktok ng isla ng katatagan ay may mga napakabigat na elemento na ang buhay ay milyun-milyong taon. Ang figure na ito ay hindi umabot sa edad ng Earth, ngunit pa rin ang pagkakaroon ng mga superheavy elemento sa kalikasan, sa ating solar system, o sa mga cosmic ray, iyon ay, sa ibang mga sistema ng ating Galaxy. Ngunit sa ngayon, hindi naging matagumpay ang mga eksperimento upang maghanap ng mga "natural" na superheavy na elemento.
Sa kasalukuyan, ang JINR ay naghahanda ng isang eksperimento upang hanapin ang ika-119 na elemento ng periodic table, at ang Laboratory of Nuclear Reactions ay isang pinuno sa mundo sa larangan ng heavy ion physics at ang synthesis ng mga superheavy elements.
Anna Maksimchuk,
Mananaliksik ng JINR,
lalo na para sa R&D.CNews.ru
Kawili-wili, siyempre. Lumalabas na marami pang kemikal na elemento at kahit na halos matatag na ang maaaring matuklasan.
Ang tanong ay lumitaw: ano ang praktikal na kahulugan ng lahat ng medyo mahal na gawaing ito upang maghanap ng mga bagong halos matatag na elemento?
Tila kapag nakahanap sila ng isang paraan upang makagawa ng mga elementong ito, makikita natin.
Pero may nakikita na ngayon. Halimbawa, kung may nanood ng pelikulang "Predator", kung gayon ang mandaragit ay may self-destruct device sa isang pulseras sa kanyang braso at ang pagsabog ay napakalakas. Kaya eto na. Ang mga bagong elemento ng kemikal na ito ay katulad ng uranium-235, ngunit ang kritikal na masa ay maaaring masukat sa gramo (at ang 1 gramo ng sangkap na ito ay katumbas ng pagsabog ng 10 toneladang TNT - isang magandang bomba na kasing laki lamang ng limang kopeck na barya. ).
Kaya't malaki ang kahulugan para sa mga siyentipiko na magtrabaho nang husto, at para sa estado na hindi magtipid sa mga gastos.
MAY LIMIT BA?
PERIODIC TABLE
D.I.MENDELEEV?
PAGTUKLAS NG MGA BAGONG ELEMENTO
P Ang problema ng systematization ng mga elemento ng kemikal ay nakakuha ng malapit na pansin sa kalagitnaan ng ika-19 siglo, nang maging malinaw na ang pagkakaiba-iba ng mga sangkap sa paligid natin ay resulta ng iba't ibang kumbinasyon ng medyo maliit na bilang ng mga elemento ng kemikal.
Sa kaguluhan ng mga elemento at ang kanilang mga compound, ang mahusay na Russian chemist na si D.I. Mendeleev ang unang nagpanumbalik ng kaayusan sa pamamagitan ng paglikha ng kanyang sariling periodic table ng mga elemento.
Ang Marso 1, 1869 ay itinuturing na araw na natuklasan ang pana-panahong batas, nang ipahayag ito ni Mendeleev sa komunidad ng siyensya. Inilagay ng siyentipiko ang 63 elemento na kilala noong panahong iyon sa kanyang talahanayan sa paraang ang mga pangunahing katangian ng mga elementong ito at ang kanilang mga compound ay nagbabago sa pana-panahon habang tumataas ang kanilang atomic mass. Ang mga naobserbahang pagbabago sa mga katangian ng mga elemento sa pahalang at patayong direksyon ng talahanayan ay sumunod sa mahigpit na mga panuntunan. Halimbawa, ang metallic (basic) na character na malinaw na ipinahayag sa mga elemento ng pangkat Ia ay bumaba sa pagtaas ng atomic mass sa kahabaan ng pahalang na talahanayan at tumaas nang patayo.
Batay sa natuklasang batas, hinulaan ni Mendeleev ang mga katangian ng ilang hindi pa natutuklasang elemento at ang kanilang lugar sa periodic table. Noong 1875, natuklasan ang "ekaaluminium" (gallium), makalipas ang apat na taon - "ekabor" (scandium), at noong 1886 - "ekasilicon" (germanium). Sa mga sumunod na taon, ang periodic table ay nagsisilbi at nagsisilbi pa ring gabay sa paghahanap ng mga bagong elemento at pag-asa ng kanilang mga ari-arian.
Gayunpaman, hindi masagot ni Mendeleev mismo o ng kanyang mga kontemporaryo ang tanong kung ano ang mga dahilan para sa periodicity ng mga katangian ng mga elemento, kung at kung saan umiiral ang hangganan periodic table. May presentiment si Mendeleev na ang dahilan ng ugnayang ipinakita niya sa pagitan ng mga katangian at atomic mass ng mga elemento ay nasa pagiging kumplikado ng mga atom mismo.
Ilang taon lamang pagkatapos ng paglikha ng pana-panahong sistema ng mga elemento ng kemikal, ang kumplikadong istraktura ng atom ay napatunayan sa mga gawa ni E. Rutherford, N. Bohr at iba pang mga siyentipiko. Ang mga kasunod na tagumpay ng atomic physics ay naging posible upang malutas ang maraming hindi malinaw na mga problema ng periodic table ng mga elemento ng kemikal. Una sa lahat, ito ay lumabas na ang lugar ng isang elemento sa periodic table ay tinutukoy hindi ng atomic mass, ngunit sa pamamagitan ng singil ng nucleus. Ang likas na katangian ng periodicity ng mga kemikal na katangian ng mga elemento at ang kanilang mga compound ay naging malinaw.
Ang atom ay nagsimulang tingnan bilang isang sistema sa gitna kung saan mayroong positibong sisingilin na nucleus, at ang mga electron na may negatibong sisingilin ay umiikot sa paligid nito. Sa kasong ito, ang mga electron ay pinagsama-sama sa perinuclear space at gumagalaw kasama ang ilang mga orbit na pumapasok sa mga shell ng elektron.
Ang lahat ng mga electron ng isang atom ay karaniwang itinalaga gamit ang mga numero at titik. Ayon sa notasyong ito, ang pangunahing mga numerong quantum 1, 2, 3, 4, 5, 6, 7 ay tumutukoy sa mga shell ng elektron, at ang mga titik s, p, d, f,
g– sa mga subshell (orbit) ng bawat shell. Ang unang shell (nagbibilang mula sa core) ay mayroon lamang s-mga electron, maaaring mayroon ang pangalawa s- At p- mga electron, pangatlo - s-, p- At d-electron, ikaapat - s-,
p-, d- At f- mga electron, atbp.
Ang bawat shell ay maaaring tumanggap ng isang napaka-tiyak na bilang ng mga electron: ang una - 2, ang pangalawa - 8, ang pangatlo - 18, ang ikaapat at ikalima - 32 bawat isa. Tinutukoy nito ang bilang ng mga elemento sa mga panahon ng periodic table. Ang mga kemikal na katangian ng mga elemento ay tinutukoy ng istraktura ng panlabas at pre-outer electronic shell ng mga atomo, i.e. sa pamamagitan ng kung gaano karaming mga electron ang nilalaman nito.
Ang nucleus ng isang atom ay binubuo ng mga particle na may positibong sisingilin - mga proton at mga neutral na particle ng elektrikal - mga neutron, kadalasang tinatawag sa isang salita - mga nucleon. Ang atomic number ng isang elemento (ang lugar nito sa periodic table) ay tinutukoy ng bilang ng mga proton sa nucleus ng isang atom ng isang partikular na elemento. Pangkalahatang numero A Ang atom ng isang elemento ay katumbas ng kabuuan ng mga bilang ng mga proton Z at mga neutron N sa kernel: A = Z + N. Ang mga atomo ng parehong elemento na may iba't ibang bilang ng mga neutron sa nucleus ay ang mga isotopes nito.
Ang mga kemikal na katangian ng iba't ibang mga isotopes ng parehong elemento ay hindi naiiba sa bawat isa, ngunit ang mga katangian ng nuklear ay malawak na nag-iiba. Ito ay ipinakita lalo na sa katatagan (o kawalang-tatag) ng mga isotopes, na makabuluhang nakasalalay sa ratio ng bilang ng mga proton at neutron sa nucleus. Ang mga light stable na isotopes ng mga elemento ay karaniwang nailalarawan sa pamamagitan ng pantay na bilang ng mga proton at neutron. Sa pagtaas ng nuclear charge, ibig sabihin, ang serial number ng elemento sa talahanayan, nagbabago ang ratio na ito. Ang matatag na mabibigat na nuclei ay may halos isa at kalahating beses na mas maraming neutron kaysa sa mga proton.
Tulad ng mga atomic electron, ang mga nucleon ay bumubuo rin ng mga shell. Habang tumataas ang bilang ng mga particle sa nucleus, sunud-sunod na napupuno ang proton at neutron shell. Ang nuclei na may ganap na punong mga shell ay ang pinaka-matatag. Halimbawa, ang isang napaka-matatag na istraktura ng nuklear ay nailalarawan sa pamamagitan ng lead isotope Pb-208, na napuno ng mga shell ng mga proton ( Z= 82) at mga neutron ( N = 126).
Ang nasabing napuno na mga nuclear shell ay katulad ng napuno na mga shell ng elektron ng mga atomo mga inert na gas, na kumakatawan sa isang natatanging pangkat sa periodic table. Ang matatag na atomic nuclei na may ganap na punong proton o neutron shell ay naglalaman ng ilang partikular na "magic" na bilang ng mga proton o neutron: 2, 8, 20, 28, 50, 82, 114, 126, 184. Kaya, ang mga atom ng mga elemento sa pangkalahatan, pati na rin ang sa mga kemikal na katangian, ang periodicity ng nuclear properties ay likas din. Kabilang sa iba't ibang kumbinasyon ng bilang ng mga proton at neutron sa nuclei ng isotopes (even-even; even-odd; odd-even; odd-odd), ito ay ang nuclei na naglalaman ng even number of protons at even number of neutrons na nakikilala sa pamamagitan ng pinakadakilang katatagan.
Ang likas na katangian ng mga puwersa na humahawak ng mga proton at neutron sa nucleus ay hindi pa malinaw. Ito ay pinaniniwalaan na ang napakalakas na gravitational forces of attraction ay kumikilos sa pagitan ng mga nucleon, na nag-aambag sa pagtaas ng katatagan ng nuclei.
SA Sa kalagitnaan ng thirties ng huling siglo, ang periodic table ay binuo nang labis na ipinakita nito ang posisyon ng 92 elemento. Ang serial number 92 ay uranium - ang huling natural na mabigat na elemento na natagpuan sa Earth noong 1789. Sa 92 na elemento ng talahanayan, ang mga elemento lamang na may mga serial number na 43, 61, 85 at 87 ang hindi tiyak na natukoy noong dekada thirties. Natuklasan at pinag-aralan sila nang maglaon. Ang bihirang elemento ng lupa na may atomic number 61, promethium, ay natagpuan sa maliit na dami sa ores bilang isang produkto ng kusang pagkabulok ng uranium. Ang isang pagsusuri sa atomic nuclei ng mga nawawalang elemento ay nagpakita na lahat sila ay radioactive, at dahil sa kanilang maikling kalahating buhay, hindi sila maaaring umiral sa Earth sa mga kapansin-pansing konsentrasyon.
Dahil sa katotohanan na ang huling mabigat na elemento na natagpuan sa Earth ay elementong may atomic number 92, maaaring ipagpalagay na ito ang natural na limitasyon ng periodic table. Gayunpaman, ang mga nakamit ng atomic physics ay nagpahiwatig ng landas kung saan naging posible na lumampas sa hangganan ng periodic table na itinakda ng kalikasan.
Mga elementong may b O Ang mga atomic number na mas mataas kaysa sa uranium ay tinatawag na transuranium. Ang mga elementong ito ay artipisyal (synthetic) sa pinagmulan. Nakukuha ang mga ito sa pamamagitan ng nuclear transformation reactions ng mga elementong matatagpuan sa kalikasan.
Ang unang pagtatangka, bagama't hindi lubos na matagumpay, upang matuklasan ang transuranium na rehiyon ng periodic table ay ginawa ng Italyano na pisiko na si Enrico Fermi sa Roma ilang sandali matapos mapatunayan ang pagkakaroon ng mga neutron. Ngunit noong 1940–1941 lamang. Nakamit ng mga Amerikanong siyentipiko mula sa Unibersidad ng California sa Berkeley ang tagumpay sa pagtuklas ng unang dalawang elemento ng transuranium, katulad ng neptunium (atomic number 93) at plutonium (atomic number 94).
Ang mga pamamaraan para sa pagkuha ng mga elemento ng transuranium ay batay sa ilang uri ng mga reaksyong nuklear.
Ang unang uri ay neutron fusion. Sa pamamaraang ito, sa nuclei ng mga mabibigat na atomo na na-irradiated ng mga neutron, ang isa sa mga neutron ay nagbabago sa isang proton. Ang reaksyon ay sinamahan ng tinatawag na electron decay (– decay) – ang pagbuo at pagbuga ng negatibong sisingilin – particle (electron) mula sa nucleus na may napakalaking kinetic energy. Posible ang reaksyon kapag mayroong labis na mga neutron sa nucleus.
Ang kabaligtaran na reaksyon ay ang pagbabagong-anyo ng isang proton sa isang neutron na may paglabas ng isang positibong sisingilin + particle (positron). Ang ganitong pagkabulok ng positron (+ pagkabulok) ay sinusunod kapag may kakulangan ng mga neutron sa nuclei at humahantong sa pagbawas sa singil ng nucleus, i.e. upang bawasan ng isa ang atomic number ng isang elemento. Ang isang katulad na epekto ay nakakamit kapag ang isang proton ay na-convert sa isang neutron sa pamamagitan ng pagkuha ng isang malapit na orbital electron.
Ang mga bagong elemento ng transuranium ay unang nakuha mula sa uranium gamit ang paraan ng neutron fusion sa mga nuclear reactor (bilang mga produkto ng pagsabog ng mga nuclear bomb), at kalaunan ay na-synthesize gamit ang mga particle accelerators - cyclotrons.
Ang pangalawang uri ay ang reaksyon sa pagitan ng nuclei ng mga atomo ng paunang elemento ("target") at ang nuclei ng mga atomo ng mga light elements (isotopes ng hydrogen, helium, nitrogen, oxygen at iba pa) na ginagamit bilang mga bombarding particle. Ang mga proton sa nuclei ng "target" at "projectile" ay may positibo singil ng kuryente at nakakaranas ng matinding pagtataboy kapag lumalapit sa isa't isa. Upang madaig ang mga salungat na pwersa at makabuo ng isang tambalang nucleus, kinakailangan na magbigay ng mga atomo ng "projectile" na may napakataas na kinetic energy. Ang gayong napakalaking enerhiya ay nakaimbak sa mga cyclotron sa pamamagitan ng pagbomba ng mga particle. Ang resultang intermediate compound nucleus ay may napakaraming labis na enerhiya, na dapat ilabas upang patatagin ang bagong nucleus. Sa kaso ng mga mabibigat na elemento ng transuranium, ang labis na enerhiya na ito, kapag hindi nangyari ang nuclear fission, ay nawawala sa pamamagitan ng paglabas ng -ray (high-energy electromagnetic radiation) at ang "pagsingaw" ng mga neutron mula sa excited na nuclei. Ang nuclei ng mga atom ng bagong elemento ay radioactive. Nagsusumikap silang makamit ang higit na pagpapanatili sa pamamagitan ng pagbabago panloob na istraktura sa pamamagitan ng radioactive electron - decay o - decay at spontaneous fission. Ang ganitong mga reaksyong nuklear ay katangian ng pinakamabibigat na atomo ng mga elemento na may mga atomic na numero na higit sa 98.
Ang reaksyon ng kusang fission ng nuclei ng mga atom ng radioactive na elemento ay natuklasan ng ating kababayan na si G.N. Flerov at ang Czech K.A. Petrzhak sa Joint Institute for Nuclear Research (JINR, Dubna) sa mga eksperimento sa uranium-238. Ang pagtaas sa atomic number ay humahantong sa isang mabilis na pagbaba sa kalahating buhay ng nuclei ng mga atom ng mga radioactive na elemento.
Kaugnay ng katotohanang ito, ang namumukod-tanging Amerikanong siyentipiko na si G.T. Seaborg, ay nagwagi Nobel Prize, na kasangkot sa pagtuklas ng siyam na elemento ng transuranium, ay naniniwala na ang pagtuklas ng mga bagong elemento ay malamang na magtatapos sa humigit-kumulang elemento bilang 110 (katulad sa mga katangian ng platinum). Ang ideyang ito tungkol sa hangganan ng periodic table ay ipinahayag noong 60s ng huling siglo na may isang caveat: maliban kung natuklasan ang mga bagong paraan ng pag-synthesize ng mga elemento at ang pagkakaroon ng hindi pa kilalang mga rehiyon ng katatagan ng pinakamabibigat na elemento. Natukoy ang ilan sa mga pagkakataong ito.
Ang ikatlong uri ng nuclear reactions para sa synthesis ng mga bagong elemento ay ang reaksyon sa pagitan ng mga high-energy ions na may average na atomic mass (calcium, titanium, chromium, nickel) bilang mga bombarding particle at atoms ng stable elements (lead, bismuth) bilang isang " target" sa halip na mabibigat na radioactive isotopes. Ang ganitong paraan ng pagkuha ng mas mabibigat na elemento ay iminungkahi noong 1973 ng ating scientist na si Yu.Ts. Oganesyan mula sa JINR at matagumpay na ginamit sa ibang mga bansa. Ang pangunahing bentahe ng iminungkahing paraan ng synthesis ay ang pagbuo ng hindi gaanong "mainit" na compound nuclei kapag ang "projectile" at "target" na nuclei ay pinagsama. Ang paglabas ng labis na enerhiya ng compound nuclei sa kasong ito ay naganap bilang isang resulta ng "pagsingaw" ng isang makabuluhang mas maliit na bilang ng mga neutron (isa o dalawa sa halip na apat o lima).
Isang hindi pangkaraniwang reaksyong nuklear sa pagitan ng mga ion ng bihirang isotope Ca-48, na pinabilis sa isang cyclotron
U-400, at mga atomo ng actinide element curium Cm-248 na may pagbuo ng element-114 (“eca-lead”) ay natuklasan sa Dubna noong 1979. Napag-alaman na sa reaksyong ito ay nabuo ang isang “malamig” na nucleus na ay hindi "nagsingaw" ng isang solong neutron, at ang lahat ng labis na enerhiya ay dinadala ng isang particle. Nangangahulugan ito na para sa synthesis ng mga bagong elemento maaari rin itong ipatupad ikaapat na uri mga reaksyong nuklear sa pagitan ng pinabilis na mga ion ng mga atom na may average na bilang ng masa at mga atomo ng mabibigat na elementong transuranic.
SA Sa pagbuo ng teorya ng pana-panahong sistema ng mga elemento ng kemikal, isang pangunahing papel ang ginampanan ng paghahambing ng mga katangian ng kemikal at istraktura ng mga electronic shell ng lanthanides na may mga serial number na 58–71 at actinides na may mga serial number na 90–103. Ipinakita na ang pagkakapareho ng mga kemikal na katangian ng lanthanides at actinides ay dahil sa pagkakapareho ng kanilang mga elektronikong istruktura. Ang parehong pangkat ng mga elemento ay isang halimbawa ng isang panloob na hilera ng paglipat na may sunud-sunod na pagpuno 4 f- o 5 f-electronic shell, ayon sa pagkakabanggit, pagkatapos punan ang panlabas s- At R-electronic na mga orbital.
Ang mga elementong may periodic table number na 110 at mas mataas ay tinatawag na superheavy. Ang pag-unlad tungo sa pagtuklas ng mga elementong ito ay lalong nagiging mahirap at tumatagal, dahil... Hindi sapat na mag-synthesize ng isang bagong elemento; kailangan itong kilalanin at patunayan na ang bagong elemento ay may mga katangiang natatangi dito. Ang mga paghihirap ay sanhi ng katotohanan na ang isang maliit na bilang ng mga atom ay magagamit upang pag-aralan ang mga katangian ng mga bagong elemento. Ang oras kung kailan maaaring pag-aralan ang isang bagong elemento bago mangyari ang radioactive decay ay kadalasang napakaikli. Sa mga kasong ito, kahit na isang atom lamang ng isang bagong elemento ang nakuha, ang paraan ng radioactive tracers ay ginagamit upang makita ito at paunang pag-aaral ng ilang mga katangian.
Ang Elemento 109, meitnerium, ay ang huling elemento sa periodic table na ipinakita sa karamihan ng mga aklat-aralin sa kimika. Ang Element 110, na kabilang sa parehong pangkat ng periodic table bilang platinum, ay unang na-synthesize sa Darmstadt (Germany) noong 1994 gamit ang isang malakas na heavy ion accelerator ayon sa reaksyon:
![]()
Ang kalahating buhay ng nagresultang isotope ay lubhang maikli. Noong Agosto 2003, opisyal na inaprubahan ng 42nd IUPAC General Assembly at ng IUPAC (International Union of Pure and Applied Chemistry) Council ang pangalan at simbolo ng elemento-110: darmstadtium, Ds.
Doon, sa Darmstadt, noong 1994, ang elemento-111 ay unang nakuha sa pamamagitan ng paglalantad ng isang sinag ng 64 28 Ni isotope ions sa 209 83 Bi atoms bilang isang "target". Sa pamamagitan ng desisyon nito noong 2004, kinilala ng IUPAC ang pagtuklas at inaprubahan ang panukalang pangalanan ang element-111 roentgenium, Rg, bilang parangal sa namumukod-tanging German physicist na si W.K. Roentgen, na natuklasan X-ray, kung saan binigyan niya ng ganoong pangalan dahil sa kawalan ng katiyakan ng kanilang kalikasan.
Ayon sa impormasyong natanggap mula sa JINR, sa Laboratory of Nuclear Reactions na pinangalanan. Nag-synthesize si G.N. Flerov ng mga elemento na may mga serial number 110–118 (maliban sa elemento-117).
Bilang resulta ng synthesis ayon sa reaksyon:
![]()
sa Darmstadt noong 1996, maraming mga atomo ng bagong elemento-112 ang nakuha, nabubulok upang palabasin - mga particle. Ang kalahating buhay ng isotope na ito ay 240 microseconds lamang. Maya-maya, sa JINR, isang paghahanap para sa mga bagong isotopes ng elemento-112 ay isinagawa sa pamamagitan ng pag-iilaw ng U-235 na mga atomo na may mga Ca-48 na ion.
Noong Pebrero 2004, sa prestihiyosong mga siyentipikong journal may mga ulat ng pagtuklas sa JINR ng aming mga siyentipiko kasama ang mga Amerikanong mananaliksik mula sa Lawrence Berkeley National Laboratory (USA) ng dalawang bagong elemento na may mga numerong 115 at 113. Ang grupong ito ng mga siyentipiko sa mga eksperimento na isinagawa noong Hulyo–Agosto 2003 sa U. -400 cyclotron na may gas-filled separator, sa reaksyon sa pagitan ng mga atomo ng Am-243 at mga ions ng isotope Ca-48, 1 atom ng isotope ng elemento-115 na may mass number na 287 at 3 atoms na may mass number ng 288 ay na-synthesize. Ang lahat ng apat na atom ng elemento-115 ay mabilis na nabulok sa paglabas ng -particle at ang pagbuo ng mga isotopes ng elemento-113 na may mass number na 282 at 284. Ang pinaka-matatag na isotope 284113 ay may kalahating buhay na humigit-kumulang 0.48 s . Ito ay bumagsak sa paglabas ng -particle at naging roentgenium isotope 280 Rg.
Noong Setyembre 2004, isang pangkat ng mga Japanese scientist mula sa Physicochemical Research Institute na pinamumunuan ni Kosuki Morita (Kosuke Morita) sinabi na sila ay nag-synthesize ng elemento-113 ayon sa reaksyon:
Kapag ito ay nabubulok sa paglabas ng -particle, ang roentgenium isotope 274 Rg ay nakuha. Dahil ito ang unang artipisyal na elemento na nakuha ng mga Japanese scientist, itinuring nilang may karapatan silang magmungkahi na tawagan itong "Japan".
Ang hindi pangkaraniwang synthesis ng isotope ng elemento 114 na may mass number na 288 mula sa curium ay nabanggit na sa itaas. Noong 1999, lumitaw ang isang mensahe tungkol sa paggawa ng parehong isotope ng elemento-114 sa JINR sa pamamagitan ng pagbomba ng mga atomo ng plutonium na may mass number na 244 na may mga Ca-48 na ion.
Inihayag din na ang mga elemento na may mga serial number na 118 at 116 ay natuklasan bilang resulta ng pangmatagalang magkasanib na pag-aaral ng mga reaksyong nukleyar ng isotopes californium Cf-249 at curium isotope Cm-245 na may sinag ng mabibigat na ions na Ca-48, dala ng mga siyentipikong Ruso at Amerikano noong panahon 2002–2005. sa JINR. Isinasara ng Element-118 ang ika-7 na yugto ng periodic table; sa mga katangian nito ay isang analogue ng noble gas radon. Ang Element-116 ay dapat magkaroon ng ilang mga katangian na karaniwan sa polonium.
Ayon sa kaugalian, ang pagtuklas ng mga bagong elemento ng kemikal at ang kanilang pagkakakilanlan ay dapat kumpirmahin sa pamamagitan ng isang desisyon ng IUPAC, ngunit ang karapatang magmungkahi ng mga pangalan para sa mga elemento ay naiwan sa mga tumutuklas. Tulad ng isang mapa ng Earth, ang periodic table ay sumasalamin sa mga pangalan ng mga teritoryo, bansa, lungsod at mga sentrong pang-agham, kung saan natuklasan at pinag-aralan ang mga elemento at ang kanilang mga compound, na-immortalize ang mga pangalan ng mga sikat na siyentipiko na gumawa ng malaking kontribusyon sa pagbuo ng pana-panahong sistema ng mga elemento ng kemikal. At hindi nagkataon na ang elemento 101 ay pinangalanan sa D.I. Mendeleev.
Upang masagot ang tanong kung saan ang hangganan ng periodic table ay maaaring magsinungaling, sa isang pagkakataon ay ginawa ang isang pagtatasa ng mga electrostatic na puwersa ng pagkahumaling ng mga panloob na electron ng mga atomo sa isang positibong sisingilin na nucleus. Ang mas mataas na atomic number ng isang elemento, mas ang electron "coat" sa paligid ng nucleus ay naka-compress, mas malakas ang panloob na mga electron ay naaakit sa nucleus. Dapat dumating ang isang sandali kapag ang mga electron ay nagsimulang makuha ng nucleus. Bilang resulta ng pagkuha at pagbabawas ng nuclear charge, ang pagkakaroon ng napakabibigat na elemento ay nagiging imposible. Ang isang katulad na sakuna na sitwasyon ay dapat lumitaw kapag ang serial number ng elemento ay 170–180.
Ang hypothesis na ito ay pinabulaanan at ipinakita na walang mga paghihigpit sa pagkakaroon ng napakabigat na elemento mula sa punto ng view ng mga ideya tungkol sa istruktura ng mga electronic shell. Ang mga limitasyon ay lumitaw bilang isang resulta ng kawalang-tatag ng nuclei mismo.
Gayunpaman, dapat sabihin na ang buhay ng mga elemento ay bumababa nang hindi regular sa pagtaas ng atomic number. Ang susunod na inaasahang rehiyon ng katatagan ng mga superheavy na elemento, dahil sa paglitaw ng mga saradong neutron o proton shell ng nucleus, ay dapat na nasa paligid ng dobleng magic nucleus na may 164 proton at 308 neutron. Ang mga posibilidad para sa pagtuklas ng mga naturang elemento ay hindi pa malinaw.
Kaya, ang tanong ng hangganan ng periodic table ng mga elemento ay nananatili pa rin. Batay sa mga patakaran para sa pagpuno ng mga electron shell ng pagtaas ng atomic number ng isang elemento, ang hinulaang ika-8 yugto ng periodic table ay dapat maglaman ng mga superactinide na elemento. Ang lugar na itinalaga sa kanila sa periodic table ni D.I. Mendeleev ay tumutugma sa III pangkat ng mga elemento, katulad ng kilalang bihirang lupa at actinide transuranium na elemento.
Sa pagtatapos ng ikalawang milenyo, ang akademikong si Vitaly Lazarevich Ginzburg ay nag-compile ng isang listahan ng tatlumpung problema sa physics at astrophysics na itinuturing niyang pinakamahalaga at kawili-wili (tingnan ang "Science and Life" No. 11, 1999). Sa listahang ito, ang numero 13 ay nagpapahiwatig ng gawain ng paghahanap ng mga superheavy na elemento. Pagkatapos, 12 taon na ang nakalilipas, ang akademiko ay nadismaya na nagsabi na "ang pag-iral ng mahabang buhay (pinag-uusapan natin ang tungkol sa milyun-milyong taon) transuranic nuclei sa cosmic rays ay hindi pa nakumpirma." Ngayon ang mga bakas ng naturang nuclei ay natuklasan. Nagbibigay ito ng pag-asa na sa wakas ay matuklasan ang Isla ng Katatagan ng superheavy nuclei, ang pagkakaroon nito ay minsang hinulaan ng nuclear physicist na si Georgy Nikolaevich Flerov.
Ang tanong ay kung may mga elementong mas mabigat kaysa sa uranium-92 (238 U ang matatag na isotope nito), sa mahabang panahon nanatiling bukas, dahil hindi sila naobserbahan sa kalikasan. Ito ay pinaniniwalaan na walang mga matatag na elemento na may atomic number na higit sa 180: ang malakas na positibong singil ng nucleus ay sisira sa mga panloob na antas ng mga electron ng isang mabigat na atom. Gayunpaman, sa lalong madaling panahon naging malinaw na ang katatagan ng isang elemento ay tinutukoy ng katatagan ng core nito, at hindi ang shell. Ang mga nuclei na may pantay na bilang ng mga proton Z at mga neutron N ay matatag, bukod sa kung saan ang mga nuclei na may tinatawag na magic number ng mga proton o neutron - 2, 8, 20, 28, 50, 82, 126 - ay lalo na kitang-kita - halimbawa, lata, tingga. At ang pinaka-matatag ay "double magic nuclei", kung saan ang bilang ng parehong mga neutron at proton ay magic, sabihin nating, helium at calcium. Ito ang lead isotope 208 Pb: mayroon itong Z = 82, N = 126. Ang katatagan ng elemento ay lubos na nakasalalay sa ratio ng bilang ng mga proton at neutron sa nucleus nito. Halimbawa, ang tingga na may 126 neutron ay matatag, ngunit ang isa pang isotope nito, na may isa pang neutron sa nucleus nito, ay nabubulok sa loob ng higit sa tatlong oras. Ngunit, nabanggit ni V.L. Ginzburg, hinuhulaan ng teorya na ang isang tiyak na elemento X na may bilang ng mga proton Z = 114 at neutrons N = 184, iyon ay, na may mass atomic number A = Z + N = 298, ay dapat mabuhay ng humigit-kumulang 100 milyong taon. .
Ngayon, maraming elemento ang artipisyal na nakuha hanggang sa at kabilang ang ika-118 - 254 Uuo. Ito ang pinakamabigat na di-metal, marahil ay isang hindi gumagalaw na gas; ang mga conventional na pangalan nito ay ununoctium (ito ay nabuo mula sa mga ugat ng Latin numerals - 1, 1, 8), eka-radon at moscovian Mw. Ang lahat ng mga elementong gawa ng tao ay dating umiral sa Earth, ngunit nabulok sa paglipas ng panahon. Halimbawa, ang plutonium-94 ay may 16 isotopes, at 244 Pu lamang ang may kalahating buhay T ½ = 7.6 10 7 taon; Ang neptunium-93 ay may 12 isotopes at 237 Np T ½ = 2.14 10 6 na taon. Ang pinakamahabang kalahating buhay na ito sa lahat ng isotopes ng mga elementong ito ay mas mababa kaysa sa edad ng Earth - (4.5–5.5) 10 9. Ang hindi gaanong mga bakas ng neptunium, na matatagpuan sa uranium ores, ay mga produkto ng nuclear reactions sa ilalim ng impluwensya ng mga neutron mula sa cosmic radiation at ang kusang fission ng uranium, at ang plutonium ay bunga ng beta decay ng neptunium-239.
Ang mga elemento na nawala sa panahon ng pagkakaroon ng Earth ay nakuha sa dalawang paraan. Una, ang isang dagdag na neutron ay maaaring itaboy sa nucleus ng isang mabigat na elemento. Doon ito sumasailalim sa beta decay, na bumubuo ng isang proton, isang electron at isang electron antineutrino: n 0 → p + e – + v e. Ang nuclear charge ay tataas ng isa - isang bagong elemento ang lilitaw. Ito ay kung paano nakuha ang mga artipisyal na elemento hanggang sa fermium-100 (ang isotope nito 257 Fm ay may kalahating buhay na 100 taon).
Kahit na ang mas mabibigat na elemento ay nilikha sa mga accelerators, na nagpapabilis at nagbabanggaan ng nuclei, halimbawa ginto (tingnan ang "Science and Life" No. 6, 1997). Ito ay eksakto kung paano nakuha ang ika-117 at ika-118 na elemento sa laboratoryo ng mga reaksyong nukleyar ng Joint Institute for Nuclear Research (JINR, Dubna). Bukod dito, hinuhulaan ng teorya na ang matatag na superheavy nuclei ay dapat umiral nang higit pa sa kasalukuyang kilalang mabibigat na radioactive na elemento. Inilarawan ng Russian physicist na si G. N. Flerov ang sistema ng mga elemento sa anyo ng isang simbolikong kapuluan, kung saan matatag na elemento napapaligiran ng isang dagat ng panandaliang isotopes na maaaring hindi kailanman matuklasan. Sa pangunahing isla ng kapuluan, mayroong mga taluktok ng pinaka-matatag na elemento - Calcium, Tin at Lead; sa kabila ng Strait of Radioactivity ay matatagpuan ang Island of Heavy Nuclei na may mga taluktok ng Uranium, Neptunium at Plutonium. At kahit na mas malayo ay dapat mayroong isang misteryosong isla ng Katatagan ng mga superheavy na elemento, katulad ng nabanggit na - X-298.
Sa kabila ng lahat ng tagumpay ng eksperimental at teoretikal na pisika, ang tanong ay nananatiling bukas: ang mga superheavy na elemento ba ay umiiral sa kalikasan, o ang mga ito ay puro artipisyal, gawa ng tao na mga sangkap, katulad ng mga sintetikong materyales - nylon, nylon, lavsan - hindi kailanman nilikha ng kalikasan?
May mga kondisyon para sa pagbuo ng mga naturang elemento sa kalikasan. Nilikha ang mga ito sa kalaliman ng mga pulsar at sa panahon ng pagsabog ng supernova. Ang mga flux ng neutron sa kanila ay umabot sa isang malaking density - 10 38 n 0 / m 2 at may kakayahang makabuo ng superheavy nuclei. Nagkalat sila sa espasyo sa isang stream ng intergalactic cosmic rays, ngunit ang kanilang bahagi ay napakaliit - ilang mga particle lamang bawat metro kuwadrado bawat taon. Samakatuwid, lumitaw ang ideya na gumamit ng isang natural na detektor-imbakan ng cosmic radiation, kung saan ang napakabigat na nuclei ay dapat mag-iwan ng isang tiyak, madaling makikilalang bakas. Ang mga meteorite ay matagumpay na nagsilbi bilang mga naturang detector.
Isang meteorite - isang piraso ng bato na napunit mula sa inang planeta nito sa pamamagitan ng ilang kosmikong sakuna - naglalakbay sa kalawakan sa daan-daang milyong taon. Ito ay patuloy na "pinaputok" ng mga cosmic ray, na binubuo ng 90% hydrogen nuclei (protons), 7% helium nuclei (dalawang proton) at 1% electron. Ang natitirang 2% ay binubuo ng iba pang mga particle, na maaaring kabilang ang superheavy nuclei.
Ang mga mananaliksik mula sa Physical Institute na pinangalanan. P. N. Lebedev (FIAN) at ang Institute of Geochemistry at Analytical Chemistry na pinangalanan. V.I. Vernadsky (GEOKHI RAS) ay nag-aaral ng dalawang pallasites - iron-nickel meteorites interspersed with olivine (isang grupo ng translucent minerals kung saan ang Mg 2, (Mg, Fe) 2 at (Mn, Fe) 2 ay idinagdag sa silicon dioxide SiO 4 in iba't ibang proporsyon; ang transparent na olivine ay tinatawag na chrysolite). Ang edad ng mga meteorites na ito ay 185 at 300 milyong taon.
Ang mabigat na nuclei, na lumilipad sa isang olivine na kristal, ay nakakasira sa sala-sala nito, na iniiwan ang kanilang mga bakas dito - mga track. Sila ay makikita pagkatapos ng kemikal na paggamot ng kristal - pag-ukit. At dahil ang olivine ay translucent, ang mga track na ito ay maaaring obserbahan at pag-aralan sa ilalim ng mikroskopyo. Sa pamamagitan ng kapal ng track, ang haba at hugis nito, maaaring hatulan ng isa ang singil at atomic mass ng nucleus. Ang pananaliksik ay lubhang kumplikado sa pamamagitan ng katotohanan na ang mga olivine na kristal ay may mga sukat ng pagkakasunud-sunod ng ilang milimetro, at ang track ng isang mabigat na butil ay mas mahaba. Samakatuwid, ang magnitude ng singil nito ay dapat hatulan ng hindi direktang data - ang rate ng pag-ukit, pagbaba sa kapal ng track, atbp.
Ang gawain upang makahanap ng mga bakas ng napakabigat na mga particle mula sa isla ng katatagan ay tinawag na "Project Olympia." Bilang bahagi ng proyektong ito, nakuha ang impormasyon sa humigit-kumulang anim na libong nuclei na may singil na higit sa 55 at tatlong ultra-heavy nuclei, na ang mga singil ay nasa saklaw mula 105 hanggang 130. Ang lahat ng mga katangian ng mga track ng mga nuclei na ito ay sinusukat ng isang kumplikadong kagamitan na may mataas na katumpakan na nilikha sa Lebedev Physical Institute. Awtomatikong kinikilala ng complex ang mga track, tinutukoy ang kanilang mga geometric na parameter at, sa pag-extrapolate ng data ng pagsukat, hinahanap ang tinantyang haba ng track bago ito huminto sa olivine massif (tandaan na ang aktwal na laki ng kristal nito ay ilang milimetro).
Ang mga pang-eksperimentong resulta na nakuha ay nagpapatunay sa katotohanan ng pagkakaroon ng mga matatag na superheavy na elemento sa kalikasan.