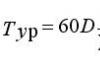28 sa periodic table. Pangkalahatang katangian ng mga elemento ng kemikal
Maraming iba't ibang bagay at bagay, buhay at walang buhay na katawan ng kalikasan ang nakapaligid sa atin. At lahat sila ay may sariling komposisyon, istraktura, mga katangian. Sa mga nabubuhay na nilalang, ang mga kumplikadong biochemical na reaksyon ay nangyayari na kasama ng mahahalagang proseso. Ang mga nonliving body ay gumaganap ng iba't ibang function sa kalikasan at biomass life at may kumplikadong molekular at atomic na komposisyon.
Ngunit lahat ng sama-sama ang mga bagay ng planeta ay mayroon karaniwang tampok: Binubuo ang mga ito ng maraming maliliit na partikulo ng istruktura na tinatawag na mga atom mga elemento ng kemikal. Napakaliit na hindi sila nakikita ng mata. Ano ang mga elemento ng kemikal? Anong mga katangian ang mayroon sila at paano mo nalaman ang tungkol sa kanilang pag-iral? Subukan nating malaman ito.
Ang konsepto ng mga elemento ng kemikal
Sa pangkalahatang tinatanggap na pag-unawa, ang mga elemento ng kemikal ay isang graphical na representasyon lamang ng mga atomo. Ang mga particle na bumubuo sa lahat ng bagay na umiiral sa Uniberso. Iyon ay, ang sumusunod na sagot ay maaaring ibigay sa tanong na "ano ang mga elemento ng kemikal". Ang mga ito ay kumplikadong maliliit na istruktura, mga koleksyon ng lahat ng isotopes ng mga atomo, pinagsama ng isang karaniwang pangalan, na may sariling graphic na pagtatalaga (simbolo).
Sa ngayon, 118 na mga elemento ang kilala na natuklasan sa natural at sintetikong paraan, sa pamamagitan ng mga reaksyong nuklear at nuclei ng iba pang mga atomo. Ang bawat isa sa kanila ay may isang hanay ng mga katangian, ang sarili nitong lokasyon sa karaniwang sistema, kasaysayan ng pagtuklas at pangalan, at gumaganap din ng isang tiyak na papel sa kalikasan at sa buhay ng mga nabubuhay na nilalang. Pinag-aaralan ng agham ng kimika ang mga katangiang ito. Ang mga elemento ng kemikal ay ang batayan para sa pagbuo ng mga molekula, simple at mga kumplikadong compound, at samakatuwid ay mga pakikipag-ugnayang kemikal.
Kasaysayan ng pagtuklas
Ang mismong pag-unawa sa kung ano ang mga elemento ng kemikal ay dumating lamang noong ika-17 siglo salamat sa gawain ni Boyle. Siya ang unang nagsalita tungkol sa konseptong ito at binigyan ito ng sumusunod na kahulugan. Ang mga ito ay hindi mahahati na maliliit mga simpleng sangkap, kung saan binubuo ang lahat ng bagay sa paligid, kabilang ang lahat ng kumplikado.
Bago ang gawaing ito, ang nangingibabaw na pananaw ng mga alchemist ay ang mga kumikilala sa teorya ng apat na elemento - sina Empidocles at Aristotle, pati na rin ang mga natuklasan ang "nasusunog na mga prinsipyo" (sulfur) at "mga prinsipyo ng metal" (mercury).
Halos buong ika-18 siglo, ang ganap na maling teorya ng phlogiston ay laganap. Gayunpaman, sa pagtatapos ng panahong ito, pinatunayan ni Antoine Laurent Lavoisier na ito ay hindi mapapatunayan. Inulit niya ang pagbabalangkas ni Boyle, ngunit kasabay nito ay dinadagdagan ito sa unang pagtatangka na i-systematize ang lahat ng mga elemento na kilala sa oras na iyon, na hinahati ang mga ito sa apat na grupo: mga metal, radical, earths, non-metal.

Ang susunod na malaking hakbang sa pag-unawa kung ano ang mga elemento ng kemikal ay nagmumula sa Dalton. Siya ay kredito sa pagtuklas ng atomic mass. Batay dito, ipinamahagi niya ang ilan sa mga kilalang elemento ng kemikal sa pagkakasunud-sunod ng pagtaas ng atomic mass.
Ang patuloy na masinsinang pag-unlad ng agham at teknolohiya ay nagpapahintulot sa amin na gumawa ng isang bilang ng mga pagtuklas ng mga bagong elemento sa komposisyon ng mga natural na katawan. Samakatuwid, noong 1869 - ang oras ng mahusay na paglikha ng D.I. Mendeleev - nalaman ng agham ang pagkakaroon ng 63 elemento. Ang gawain ng siyentipikong Ruso ay naging unang kumpleto at walang hanggang itinatag na pag-uuri ng mga particle na ito.
Ang istraktura ng mga elemento ng kemikal ay hindi naitatag noong panahong iyon. Ito ay pinaniniwalaan na ang atom ay hindi mahahati, na ito ang pinakamaliit na yunit. Sa pagtuklas ng phenomenon ng radioactivity, napatunayang nahahati ito sa mga structural parts. Halos lahat ay umiiral sa anyo ng ilang natural na isotopes (magkatulad na mga particle, ngunit may ibang bilang ng mga istruktura ng neutron, na nagbabago sa atomic mass). Kaya, sa kalagitnaan ng huling siglo, posible na makamit ang pagkakasunud-sunod sa kahulugan ng konsepto ng isang elemento ng kemikal.
Sistema ng mga elemento ng kemikal ni Mendeleev
Ibinatay ito ng siyentipiko sa pagkakaiba sa atomic mass at pinamamahalaang mapanlikhang ayusin ang lahat ng kilalang elemento ng kemikal sa pagtaas ng pagkakasunud-sunod. Gayunpaman, ang buong lalim at henyo ng kanyang pang-agham na pag-iisip at pag-iintindi sa kinabukasan ay nakasalalay sa katotohanan na si Mendeleev ay nag-iwan ng mga walang laman na puwang sa kanyang sistema, mga bukas na mga cell para sa hindi pa kilalang mga elemento, na, ayon sa siyentipiko, ay matutuklasan sa hinaharap.
At lahat ay naging eksakto tulad ng sinabi niya. Pinuno ng mga kemikal na elemento ni Mendeleev ang lahat ng mga walang laman na selula sa paglipas ng panahon. Ang bawat istraktura na hinulaan ng siyentipiko ay natuklasan. At ngayon maaari nating ligtas na sabihin na ang sistema ng mga elemento ng kemikal ay kinakatawan ng 118 na mga yunit. Totoo, ang huling tatlong pagtuklas ay hindi pa opisyal na nakumpirma.
Ang sistema ng mga elemento ng kemikal mismo ay ipinapakita nang grapiko sa isang talahanayan kung saan ang mga elemento ay nakaayos ayon sa hierarchy ng kanilang mga katangian, mga singil sa nuklear at mga tampok na istruktura ng mga elektronikong shell ng kanilang mga atomo. Kaya, may mga tuldok (7 piraso) - pahalang na hilera, grupo (8 piraso) - patayo, subgroup (pangunahin at pangalawa sa loob ng bawat pangkat). Kadalasan, ang dalawang hanay ng mga pamilya ay inilalagay nang hiwalay sa mas mababang mga layer ng talahanayan - lanthanides at actinides.

Ang atomic mass ng isang elemento ay binubuo ng mga proton at neutron, ang kumbinasyon nito ay tinatawag na "mass number". Ang bilang ng mga proton ay tinutukoy nang napakasimple - ito ay katumbas ng atomic number ng elemento sa system. At dahil ang atom sa kabuuan ay isang electrically neutral na sistema, iyon ay, walang singil sa lahat, ang bilang ng mga negatibong electron ay palaging katumbas ng bilang ng mga positibong proton particle.
Kaya, ang mga katangian ng isang elemento ng kemikal ay maaaring ibigay sa pamamagitan ng posisyon nito sa periodic table. Pagkatapos ng lahat, halos lahat ay inilarawan sa cell: ang serial number, na nangangahulugang mga electron at proton, atomic mass (ang average na halaga ng lahat ng umiiral na isotopes ng isang naibigay na elemento). Makikita mo kung saang panahon matatagpuan ang istraktura (nangangahulugan ito na ang mga electron ay matatagpuan sa napakaraming mga layer). Posible ring hulaan ang bilang ng mga negatibong particle sa huling antas ng enerhiya para sa mga elemento ng pangunahing subgroup - katumbas ito ng bilang ng pangkat kung saan matatagpuan ang elemento.

Ang bilang ng mga neutron ay maaaring kalkulahin sa pamamagitan ng pagbabawas ng mga proton mula sa mass number, iyon ay, ang atomic number. Kaya, posible na makakuha at mag-compile ng isang buong electron-graphic na formula para sa bawat elemento ng kemikal, na tumpak na magpapakita ng istraktura nito at magpapakita ng posible at ipinahayag na mga katangian.
Pamamahagi ng mga elemento sa kalikasan
Pinag-aaralan ng buong agham ang isyung ito - cosmochemistry. Ipinapakita ng data na ang distribusyon ng mga elemento sa ating planeta ay sumusunod sa parehong mga pattern sa Uniberso. Ang pangunahing pinagmumulan ng nuclei ng magaan, mabigat at katamtamang mga atomo ay mga reaksyong nuklear na nagaganap sa loob ng mga bituin - nucleosynthesis. Salamat sa mga prosesong ito, ang Uniberso at kalawakan ay nagbigay sa ating planeta ng lahat ng magagamit na elemento ng kemikal.
Sa kabuuan, sa kilalang 118 na kinatawan sa mga likas na pinagkukunan, 89 ang natuklasan ng mga tao. Ito ang pangunahing, pinakakaraniwang mga atomo. Ang mga elemento ng kemikal ay na-synthesize din nang artipisyal sa pamamagitan ng pagbomba sa nuclei ng mga neutron (laboratory nucleosynthesis).

Ang pinakamarami ay ang mga simpleng sangkap ng mga elemento tulad ng nitrogen, oxygen, at hydrogen. Ang carbon ay bahagi ng lahat ng mga organikong sangkap, na nangangahulugang ito ay sumasakop din sa isang nangungunang posisyon.
Pag-uuri ayon sa elektronikong istraktura ng mga atom
Isa sa mga pinakakaraniwang klasipikasyon ng lahat ng elemento ng kemikal ng isang sistema ay ang kanilang pamamahagi batay sa elektronikong istraktura. Batay sa kung gaano karaming mga antas ng enerhiya ang kasama sa shell ng isang atom at kung alin sa mga ito ang naglalaman ng mga huling valence electron, apat na grupo ng mga elemento ang maaaring makilala.
S-elemento
Ito ang mga kung saan ang s-orbital ang huling napupunan. Kasama sa pamilyang ito ang mga elemento ng unang pangkat ng pangunahing subgroup (o Isang elektron lamang sa panlabas na antas ang tumutukoy sa mga katulad na katangian ng mga kinatawan na ito bilang malakas na mga ahente ng pagbabawas.
P-elemento
30 piraso lang. Ang mga electron ng Valence ay matatagpuan sa p-sublevel. Ito ang mga elemento na bumubuo sa mga pangunahing subgroup mula sa ikatlo hanggang sa ikawalong grupo, na kabilang sa mga panahon 3,4,5,6. Kabilang sa mga ito, ang mga katangian ay kinabibilangan ng parehong mga metal at tipikal na di-metal na elemento.
d-elemento at f-elemento
Ang mga ito ay mga transition metal mula sa ika-4 hanggang ika-7 pangunahing panahon. Mayroong 32 elemento sa kabuuan. Ang mga simpleng sangkap ay maaaring magpakita ng parehong acidic at pangunahing mga katangian (pag-oxidizing at pagbabawas). Gayundin amphoteric, iyon ay, dalawahan.
Kasama sa f-family ang lanthanides at actinides, kung saan ang mga huling electron ay matatagpuan sa f-orbitals.
Mga sangkap na nabuo ng mga elemento: simple
Gayundin, ang lahat ng klase ng mga elemento ng kemikal ay maaaring umiral sa anyo ng simple o kumplikadong mga compound. Kaya, ang mga simple ay itinuturing na mga nabuo mula sa parehong istraktura sa iba't ibang dami. Halimbawa, ang O 2 ay oxygen o dioxygen, at ang O 3 ay ozone. Ang kababalaghang ito ay tinatawag na allotropy.

Ang mga simpleng elemento ng kemikal na bumubuo ng mga compound ng parehong pangalan ay katangian ng bawat kinatawan ng periodic table. Ngunit hindi lahat ng mga ito ay pareho sa kanilang mga ari-arian. Kaya, may mga simpleng sangkap, metal at di-metal. Ang una ay bumubuo sa mga pangunahing subgroup na may 1-3 grupo at lahat ng pangalawang subgroup sa talahanayan. Ang mga di-metal ay bumubuo sa mga pangunahing subgroup ng mga pangkat 4-7. Kasama sa ikawalong pangunahing elemento ang mga espesyal na elemento - marangal o hindi gumagalaw na mga gas.
Sa lahat ng bukas ngayon simpleng elemento 11 gas, 2 likidong sangkap (bromine at mercury) ay kilala sa ilalim ng normal na mga kondisyon, ang lahat ng iba ay solid.
Mga kumplikadong koneksyon
Kabilang dito ang lahat ng bagay na binubuo ng dalawa o higit pang kemikal na elemento. Maraming mga halimbawa, dahil higit sa 2 milyong mga kemikal na compound ang kilala! Ito ay mga salts, oxides, bases at acids, complex compounds, lahat ng organic substances.
Eter sa periodic table
Ang mundo eter ay ang sangkap ng BAWAT elemento ng kemikal at, samakatuwid, BAWAT sangkap; ito ay ang Ganap na tunay na bagay bilang ang Pangkalahatang Esensya na bumubuo ng elemento.Ang mundo eter ay ang pinagmulan at korona ng buong tunay na Periodic Table, ang simula at pagtatapos nito - ang alpha at omega ng Periodic Table of Elements ni Dmitry Ivanovich Mendeleev.
SA sinaunang pilosopiya Ang eter (aithér-Greek), kasama ang lupa, tubig, hangin at apoy, ay isa sa limang elemento ng pagiging (ayon kay Aristotle) - ang ikalimang diwa (quinta essentia - Latin), na nauunawaan bilang ang pinakamahusay na lahat-lahat. bagay. SA huli XIX siglo, ang hypothesis ng isang unibersal na eter (ME) na pumupuno sa lahat ng espasyo sa mundo ay naging malawak na circulated sa siyentipikong mga lupon. Ito ay naunawaan bilang isang walang timbang at nababanat na likido na tumatagos sa lahat ng katawan. Sinubukan nilang ipaliwanag ang maraming pisikal na phenomena at katangian sa pamamagitan ng pagkakaroon ng eter.
Paunang Salita.
Si Mendeleev ay may dalawang pangunahing natuklasang siyentipiko:
1 - Pagtuklas ng Pana-panahong Batas sa sangkap ng kimika,
2 - Pagtuklas ng ugnayan sa pagitan ng substance ng chemistry at ng substance ng Ether, lalo na: ang mga particle ng Ether ay bumubuo ng mga molekula, nuclei, electron, atbp., ngunit hindi nakikilahok sa mga reaksiyong kemikal.
Ang eter ay mga particle ng matter ~ 10-100 metro ang laki (sa katunayan, sila ang "unang brick" ng matter).
Data. Si Ether ay nasa orihinal na periodic table. Ang cell para sa Ether ay matatagpuan sa zero group na may mga inert na gas at sa zero row bilang pangunahing system-forming factor para sa pagbuo ng System of chemical elements. Pagkatapos ng kamatayan ni Mendeleev, ang talahanayan ay nasira sa pamamagitan ng pag-alis ng Ether mula dito at pag-aalis ng zero na grupo, sa gayon ay itinatago ang pangunahing pagtuklas ng konseptong kahalagahan.
Sa modernong mga talahanayan ng Ether: 1 - hindi nakikita, 2 - hindi nahuhulaan (dahil sa kawalan ng zero group).
Ang ganitong may layuning pamemeke ay humahadlang sa pag-unlad ng pag-unlad ng sibilisasyon.
Ang mga sakuna na gawa ng tao (hal. Chernobyl at Fukushima) ay naiwasan sana kung ang sapat na mapagkukunan ay namuhunan sa isang napapanahong paraan sa pagbuo ng isang tunay na periodic table. Ang pagtatago ng konseptong kaalaman ay nangyayari sa pandaigdigang antas upang "ibaba" ang sibilisasyon.
Resulta. Sa mga paaralan at unibersidad ay nagtuturo sila ng crop na periodic table.
Pagtatasa ng sitwasyon. Ang periodic table na walang Ether ay kapareho ng sangkatauhan na walang mga anak - maaari kang mabuhay, ngunit walang pag-unlad at walang hinaharap.
Buod. Kung ang mga kaaway ng sangkatauhan ay nagtatago ng kaalaman, kung gayon ang ating gawain ay ihayag ang kaalamang ito.
Konklusyon. Ang lumang periodic table ay may mas kaunting elemento at higit na foresight kaysa sa modernong isa.
Konklusyon. Bagong antas ay posible lamang kapag nagbabago ang estado ng impormasyon ng lipunan.
Bottom line. Ang pagbabalik sa totoong periodic table ay hindi na isang pang-agham na tanong, ngunit isang pampulitika na tanong.

Ano ang pangunahing pampulitikang kahulugan ng pagtuturo ni Einstein? Binubuo ito ng pagputol ng pag-access ng sangkatauhan sa hindi mauubos na likas na mapagkukunan ng enerhiya sa anumang paraan, na binuksan sa pamamagitan ng pag-aaral ng mga katangian ng mundo eter. Kung matagumpay sa landas na ito, ang pandaigdigang oligarkiya sa pananalapi ay mawawalan ng kapangyarihan sa mundong ito, lalo na sa liwanag ng pagbabalik-tanaw ng mga taong iyon: ang Rockefellers ay gumawa ng isang hindi maisip na kapalaran, na lumampas sa badyet ng Estados Unidos, sa haka-haka ng langis, at ang pagkawala. sa papel ng langis na ginagampanan ng "itim na ginto" sa mundong ito - ang papel ng buhay ng pandaigdigang ekonomiya - ay hindi nagbigay inspirasyon sa kanila.
Hindi ito nagbigay inspirasyon sa iba pang mga oligarko - ang mga hari ng karbon at bakal. Kaya, ang financial tycoon na si Morgan ay agad na huminto sa pagpopondo sa mga eksperimento ni Nikola Tesla nang malapit na siya sa wireless na paglipat ng enerhiya at pagkuha ng enerhiya "wala saanman" - mula sa eter ng mundo. Pagkatapos nito, ang may-ari ng isang malaking bilang ng mga teknikal na solusyon na isinagawa ay hindi ibinigay tulong pinansyal walang sinuman - ang pagkakaisa ng mga financial tycoon ay katulad ng mga magnanakaw sa batas at isang kahanga-hangang ilong kung saan nagmumula ang panganib. Kaya naman laban sa sangkatauhan at isang sabotahe ang isinagawa sa ilalim ng pangalang "Special Theory of Relativity".
Ang isa sa mga unang suntok ay dumating sa talahanayan ni Dmitry Mendeleev, kung saan ang eter ay ang unang numero; ito ay mga pag-iisip tungkol sa eter na nagsilang ng napakatalino na pananaw ni Mendeleev - ang kanyang pana-panahong talahanayan ng mga elemento.

Kabanata mula sa artikulo: V.G. Rodionov. Ang lugar at papel ng mundo eter sa totoong talahanayan ng D.I. Mendeleev
6. Argumentum ad rem
Ano ang itinuturo ngayon sa mga paaralan at unibersidad sa ilalim ng pangalang " Periodic table mga elemento ng kemikal D.I. Mendeleev,” ay isang tahasang kasinungalingan.
Ang huling pagkakataon na ang tunay na Periodic Table ay nai-publish sa isang undistorted form ay noong 1906 sa St. Petersburg (textbook "Fundamentals of Chemistry", VIII edition). At pagkatapos lamang ng 96 na taon ng pagkalimot, ang orihinal na Periodic Table ay bumangon sa unang pagkakataon mula sa abo salamat sa paglalathala ng isang disertasyon sa journal ZhRFM ng Russian Physical Society.
Matapos ang biglaang pagkamatay ni D.I. Mendeleev at ang pagpanaw ng kanyang tapat na mga kasamahan sa siyensya sa Russian Physico-Chemical Society, ang anak ng kaibigan at kasamahan ni D.I. Mendeleev sa Lipunan, si Boris Nikolaevich Menshutkin, ay unang nagtaas ng kanyang kamay sa walang kamatayang paglikha ni Mendeleev. Siyempre, hindi kumilos si Menshutkin nang mag-isa - isinagawa lamang niya ang utos. Pagkatapos ng lahat, ang bagong paradigma ng relativism ay nangangailangan ng pag-abandona sa ideya ng mundo eter; at samakatuwid ang pangangailangang ito ay itinaas sa ranggo ng dogma, at ang gawa ni D.I. Mendeleev ay napeke.
Ang pangunahing pagbaluktot ng Table ay ang paglipat ng "zero group" ng Table sa dulo nito, sa kanan, at ang pagpapakilala ng tinatawag na. "mga panahon". Binibigyang-diin namin na ang gayong (sa unang sulyap, hindi nakakapinsala) na pagmamanipula ay lohikal na maipaliwanag lamang bilang isang sinasadyang pag-aalis ng pangunahing metodolohikal na link sa pagtuklas ni Mendeleev: ang pana-panahong sistema ng mga elemento sa simula nito, pinagmulan, i.e. sa itaas na kaliwang sulok ng Talahanayan, dapat magkaroon ng isang zero na grupo at isang zero na hilera, kung saan matatagpuan ang elementong "X" (ayon kay Mendeleev - "Newtonium"), - i.e. broadcast sa mundo.
Higit pa rito, bilang nag-iisang elementong bumubuo ng system ng buong Talahanayan ng mga Hinangong Elemento, ang elementong "X" na ito ay ang argumento ng buong Periodic Table. Ang paglipat ng zero group ng Table hanggang sa dulo nito ay sumisira sa mismong ideya ng pangunahing prinsipyong ito ng buong sistema ng mga elemento ayon kay Mendeleev.
Upang kumpirmahin ang nasa itaas, ibibigay namin ang sahig kay D.I. Mendeleev mismo.
"... Kung ang mga argon analogues ay hindi nagbibigay ng mga compound, kung gayon ito ay malinaw na imposibleng isama ang alinman sa mga grupo ng mga dating kilalang elemento, at para sa kanila ang isang espesyal na grupo ng zero ay dapat buksan... Ang posisyon na ito ng argon analogues sa zero group ay isang mahigpit na lohikal na kinahinatnan ng pag-unawa sa pana-panahong batas, at samakatuwid (ang pagkakalagay sa pangkat VIII ay malinaw na hindi tama) ay tinanggap hindi lamang sa akin, kundi pati na rin ni Braizner, Piccini at iba pa... Ngayon, kapag ito ay naging lampas sa kaunting pagdududa na bago ang pangkat na iyon, kung saan dapat ilagay ang hydrogen, mayroong isang zero na grupo, na ang mga kinatawan ay may atomic na timbang na mas mababa kaysa sa mga elemento ng pangkat I, tila imposibleng tanggihan ang pagkakaroon. ng mga elementong mas magaan kaysa sa hydrogen.


Sa mga ito, bigyang-pansin muna natin ang elemento ng unang hilera ng 1st group. Tinutukoy namin ito sa pamamagitan ng "y". Malinaw na magkakaroon ito ng mga pangunahing katangian ng mga argon gas ... "Coronium", na may density na humigit-kumulang 0.2 na may kaugnayan sa hydrogen; at hindi ito sa anumang paraan ay ang mundo eter.
Ang elementong ito na "y", gayunpaman, ay kinakailangan upang mental na makalapit sa pinakamahalagang iyon, at samakatuwid ang pinakamabilis na gumagalaw na elementong "x", na, sa aking pag-unawa, ay maaaring ituring na eter. Gusto kong pansamantalang tawagan itong "Newtonium" - bilang parangal sa walang kamatayang Newton... Ang problema ng grabitasyon at ang problema ng lahat ng enerhiya (!!! - V. Rodionov) ay hindi maiisip na talagang malulutas nang walang tunay na pag-unawa ng eter bilang isang daluyan ng mundo na nagpapadala ng enerhiya sa mga distansya. Ang isang tunay na pag-unawa sa eter ay hindi makakamit sa pamamagitan ng pagwawalang-bahala sa kimika nito at hindi isinasaalang-alang ito bilang isang elementong elemento; ang mga elementong elementarya ay hindi na maiisip ngayon kung wala ang kanilang pagpapailalim sa pana-panahong batas” (“An Attempt at a Chemical Understanding of the World Ether.” 1905, p. 27).

"Ang mga elementong ito, ayon sa laki ng kanilang mga atomic na timbang, ay kumuha ng isang tiyak na lugar sa pagitan ng mga halides at mga alkali na metal, gaya ng ipinakita ni Ramsay noong 1900. Mula sa mga elementong ito kinakailangan na bumuo ng isang espesyal na zero group, na unang kinilala ni Errere sa Belgium noong 1900. Itinuturing kong kapaki-pakinabang na idagdag dito na, direktang hinuhusgahan ng kawalan ng kakayahang pagsamahin ang mga elemento ng grupo zero, ang mga analogue ng argon ay dapat ilagay bago ang mga elemento ng pangkat 1 at, sa diwa ng periodic system, asahan ang isang mas mababang atomic na timbang para sa kanila kaysa sa para sa mga metal na alkali.
Ito ay eksakto kung ano ito ay naging. At kung gayon, kung gayon ang pangyayaring ito, sa isang banda, ay nagsisilbing kumpirmasyon ng kawastuhan ng mga pana-panahong prinsipyo, at sa kabilang banda, ay malinaw na nagpapakita ng kaugnayan ng argon analogs sa iba pang mga dating kilalang elemento. Bilang resulta, posibleng ilapat ang nasuri na mga prinsipyo nang mas malawak kaysa dati, at asahan ang mga elemento ng zero series na may atomic weight na mas mababa kaysa sa hydrogen.
Kaya, maipapakita na sa unang hilera, una bago ang hydrogen, mayroong isang elemento ng zero group na may atomic weight na 0.4 (marahil ito ay Yong's coronium), at sa zero row, sa zero group, mayroong ay isang naglilimitang elemento na may maliit na atomic na timbang, hindi kaya ng mga kemikal na pakikipag-ugnayan at, bilang resulta, nagtataglay ng napakabilis na partial (gas) na paggalaw ng sarili nitong.
Ang mga pag-aari na ito, marahil, ay dapat na maiugnay sa mga atomo ng lahat-ng-pervading (!!! - V. Rodionov) mundo eter. Ipinahiwatig ko ang ideyang ito sa paunang salita sa publikasyong ito at sa isang artikulo sa journal na Ruso noong 1902...” (“Fundamentals of Chemistry.” VIII ed., 1906, p. 613 et seq.)
1 , , ,
Mula sa mga komento:
Para sa kimika, ang modernong periodic table ng mga elemento ay sapat.
Ang papel na ginagampanan ng eter ay maaaring maging kapaki-pakinabang sa mga reaksyong nuklear, ngunit ito ay hindi masyadong makabuluhan.
Isinasaalang-alang ang impluwensya ng eter ay pinakamalapit sa mga phenomena ng isotope decay. Gayunpaman, ang accounting na ito ay lubhang kumplikado at ang pagkakaroon ng mga pattern ay hindi tinatanggap ng lahat ng mga siyentipiko.
Ang pinakasimpleng patunay ng pagkakaroon ng eter: Ang kababalaghan ng pagkawasak ng isang pares ng positron-electron at ang paglitaw ng pares na ito mula sa isang vacuum, pati na rin ang imposibilidad ng paghuli ng isang elektron sa pahinga. Gayundin ang electromagnetic field at isang kumpletong pagkakatulad sa pagitan ng mga photon sa isang vacuum at sound waves - phonon sa mga kristal.
Ang eter ay pinag-iba-iba na bagay, wika nga, mga atomo sa isang disassembled na estado, o mas tama, mga elementarya na particle kung saan nabuo ang mga atom sa hinaharap. Samakatuwid, wala itong lugar sa periodic table, dahil ang lohika ng pagbuo ng sistemang ito ay hindi nagpapahiwatig ng pagsasama ng mga di-integral na istruktura, na ang mga atomo mismo. Kung hindi, posible na makahanap ng isang lugar para sa mga quark, sa isang lugar sa minus na unang yugto.
Ang eter mismo ay may mas kumplikadong multi-level na istraktura ng pagpapakita sa pagkakaroon ng mundo kaysa sa nalalaman tungkol dito modernong agham. Sa sandaling ibunyag niya ang mga unang lihim ng mailap na eter na ito, ang mga bagong makina para sa lahat ng uri ng makina ay maiimbento sa ganap na bagong mga prinsipyo.
Sa katunayan, si Tesla ay marahil ang isa lamang na malapit sa paglutas ng misteryo ng tinatawag na eter, ngunit sadyang pinigilan siyang mapagtanto ang kanyang mga plano. Kaya, hanggang ngayon, ang henyo na magpapatuloy sa gawain ng dakilang imbentor at magsasabi sa ating lahat kung ano talaga ang misteryosong eter at kung saang pedestal ito mailalagay ay hindi pa naipanganak.
Kung nahihirapan kang maunawaan ang periodic table, hindi ka nag-iisa! Bagama't maaaring mahirap maunawaan ang mga prinsipyo nito, ang pag-alam kung paano ito gamitin ay makakatulong sa iyong matuto mga likas na agham. Una, pag-aralan ang istraktura ng talahanayan at kung anong impormasyon ang maaari mong matutunan mula dito tungkol sa bawat elemento ng kemikal. Pagkatapos ay maaari mong simulang pag-aralan ang mga katangian ng bawat elemento. At sa wakas, gamit ang periodic table, matutukoy mo ang bilang ng mga neutron sa isang atom ng isang partikular na elemento ng kemikal.
Mga hakbang
Bahagi 1
Istraktura ng talahanayan- Halimbawa, ang unang hilera ng talahanayan ay naglalaman ng hydrogen, na may atomic number 1, at helium, na may atomic number 2. Gayunpaman, ang mga ito ay matatagpuan sa magkabilang gilid dahil nabibilang sila sa iba't ibang grupo.
-
Matuto tungkol sa mga pangkat na kinabibilangan ng mga elementong may magkatulad na pisikal at mga katangian ng kemikal. Ang mga elemento ng bawat pangkat ay matatagpuan sa kaukulang vertical column. Karaniwang nakikilala ang mga ito sa pamamagitan ng parehong kulay, na tumutulong sa pagtukoy ng mga elementong may magkatulad na katangiang pisikal at kemikal at mahulaan ang kanilang pag-uugali. Ang lahat ng mga elemento ng isang partikular na grupo ay mayroon parehong numero mga electron sa panlabas na shell.
- Ang hydrogen ay maaaring mauri bilang parehong alkali metal at halogens. Sa ilang mga talahanayan ito ay ipinahiwatig sa parehong mga grupo.
- Sa karamihan ng mga kaso, ang mga grupo ay binibilang mula 1 hanggang 18, at ang mga numero ay inilalagay sa itaas o ibaba ng talahanayan. Maaaring tukuyin ang mga numero sa mga numerong Romano (hal. IA) o Arabic (hal. 1A o 1).
- Kapag gumagalaw sa isang column mula sa itaas hanggang sa ibaba, sinasabing "nagba-browse ka sa isang grupo."
-
Alamin kung bakit may mga walang laman na cell sa talahanayan. Ang mga elemento ay inayos hindi lamang ayon sa kanilang atomic number, kundi pati na rin sa pamamagitan ng pangkat (mga elemento sa parehong grupo ay may magkatulad na pisikal at kemikal na mga katangian). Dahil dito, mas madaling maunawaan kung paano kumikilos ang isang partikular na elemento. Gayunpaman, habang tumataas ang atomic number, ang mga elementong nahuhulog sa kaukulang grupo ay hindi palaging matatagpuan, kaya may mga walang laman na cell sa talahanayan.
- Halimbawa, ang unang 3 row ay may mga walang laman na cell dahil ang mga transition metal ay matatagpuan lamang mula sa atomic number 21.
- Ang mga elementong may atomic number na 57 hanggang 102 ay inuri bilang rare earth elements, at kadalasang inilalagay sa sarili nilang subgroup sa kanang sulok sa ibaba ng talahanayan.
-
Ang bawat hilera ng talahanayan ay kumakatawan sa isang tuldok. Ang lahat ng mga elemento ng parehong panahon ay may parehong bilang ng mga atomic orbital kung saan matatagpuan ang mga electron sa mga atomo. Ang bilang ng mga orbital ay tumutugma sa bilang ng panahon. Ang talahanayan ay naglalaman ng 7 row, iyon ay, 7 tuldok.
- Halimbawa, ang mga atomo ng mga elemento ng unang yugto ay may isang orbital, at ang mga atomo ng mga elemento ng ikapitong yugto ay may 7 orbital.
- Bilang isang patakaran, ang mga tuldok ay itinalaga ng mga numero mula 1 hanggang 7 sa kaliwa ng talahanayan.
- Habang lumilipat ka sa isang linya mula kaliwa pakanan, sinasabing "ini-scan mo ang period."
-
Alamin ang pagkakaiba sa pagitan ng mga metal, metalloid at di-metal. Mas mauunawaan mo ang mga katangian ng isang elemento kung matutukoy mo kung anong uri ito. Para sa kaginhawahan, sa karamihan ng mga talahanayan, ang mga metal, metalloid, at nonmetals ay itinalaga ng iba't ibang kulay. Ang mga metal ay nasa kaliwa at ang mga hindi metal ay nasa kanang bahagi ng mesa. Ang mga metalloid ay matatagpuan sa pagitan nila.
Bahagi 2
Mga pagtatalaga ng elemento-
Ang bawat elemento ay itinalaga ng isa o dalawang letrang Latin. Bilang isang patakaran, ang simbolo ng elemento ay ipinapakita sa malalaking titik sa gitna ng kaukulang cell. Ang simbolo ay isang pinaikling pangalan para sa isang elemento na pareho sa karamihan ng mga wika. Kapag nagsasagawa ng mga eksperimento at nagtatrabaho kasama mga equation ng kemikal ang mga simbolo ng elemento ay karaniwang ginagamit, kaya kapaki-pakinabang na tandaan ang mga ito.
- Karaniwan, ang mga simbolo ng elemento ay mga pagdadaglat ng kanilang Latin na pangalan, bagama't para sa ilan, lalo na ang mga kamakailang natuklasang elemento, ang mga ito ay nagmula sa karaniwang pangalan. Halimbawa, ang helium ay kinakatawan ng simbolong He, na malapit sa karaniwang pangalan sa karamihan ng mga wika. Kasabay nito, ang bakal ay itinalaga bilang Fe, na isang pagdadaglat ng Latin na pangalan nito.
-
Bigyang-pansin ang buong pangalan ng elemento kung ito ay ibinigay sa talahanayan. Ang elementong "pangalan" ay ginagamit sa ordinaryong mga teksto. Halimbawa, ang "helium" at "carbon" ay mga pangalan ng mga elemento. Karaniwan, bagaman hindi palaging, buong pangalan Ang mga elemento ay ipinahiwatig sa ilalim ng kanilang kemikal na simbolo.
- Minsan ang talahanayan ay hindi nagpapahiwatig ng mga pangalan ng mga elemento at nagbibigay lamang ng kanilang mga simbolo ng kemikal.
-
Hanapin ang atomic number. Karaniwan, ang atomic number ng isang elemento ay matatagpuan sa tuktok ng kaukulang cell, sa gitna o sa sulok. Maaari rin itong lumitaw sa ilalim ng simbolo o pangalan ng elemento. Ang mga elemento ay may mga atomic na numero mula 1 hanggang 118.
- Ang atomic number ay palaging isang integer.
-
Tandaan na ang atomic number ay tumutugma sa bilang ng mga proton sa isang atom. Ang lahat ng mga atom ng isang elemento ay naglalaman ng parehong bilang ng mga proton. Hindi tulad ng mga electron, ang bilang ng mga proton sa mga atomo ng isang elemento ay nananatiling pare-pareho. Kung hindi, makakakuha ka ng ibang elemento ng kemikal!
-
Ang periodic table, o periodic table ng mga elemento ng kemikal, ay nagsisimula sa kaliwa itaas na sulok at nagtatapos sa dulo ng huling hilera ng talahanayan (kanang sulok sa ibaba). Ang mga elemento sa talahanayan ay nakaayos mula kaliwa hanggang kanan sa pagtaas ng pagkakasunud-sunod ng kanilang atomic number. Ang atomic number ay nagpapakita kung gaano karaming mga proton ang nakapaloob sa isang atom. Bilang karagdagan, habang tumataas ang atomic number, tumataas din ang atomic mass. Kaya, sa pamamagitan ng lokasyon ng isang elemento sa periodic table, ang atomic mass nito ay maaaring matukoy.
Tulad ng nakikita mo, ang bawat kasunod na elemento ay naglalaman ng isa pang proton kaysa sa elementong nauna rito. Ito ay malinaw kapag tiningnan mo ang mga atomic na numero. Ang mga atomic number ay tumataas ng isa habang lumilipat ka mula kaliwa pakanan. Dahil ang mga elemento ay nakaayos sa mga pangkat, ang ilang mga cell ng talahanayan ay naiwang walang laman.
PERIODIC TABLE NI MENDELEEV
Ang pagtatayo ng periodic table ni Mendeleev ng mga elemento ng kemikal ay tumutugma sa mga katangiang panahon ng teorya ng numero at orthogonal na mga base. Ang pagdaragdag ng mga Hadamard matrice na may mga matrice ng even at odd na mga order ay lumilikha ng isang istrukturang batayan ng mga nested na elemento ng matrix: mga matrice ng una (Odin), pangalawa (Euler), pangatlo (Mersenne), pang-apat (Hadamard) at panglima (Fermat) na mga order.
Madaling makita na mayroong 4 na order k Ang mga matrice ng Hadamard ay tumutugma sa mga inert na elemento na may atomic mass na maramihang apat: helium 4, neon 20, argon 40 (39.948), atbp., ngunit din ang mga pangunahing kaalaman sa buhay at digital na teknolohiya: carbon 12, oxygen 16, silicon 28 , germanium 72.
Tila na may Mersenne matrices ng mga order 4 k–1, sa kabaligtaran, lahat ng aktibo, lason, mapanira at kinakaing unti-unti ay konektado. Ngunit ito rin ay mga radioactive na elemento - pinagmumulan ng enerhiya, at lead 207 (ang huling produkto, mga nakakalason na asing-gamot). Ang fluorine, siyempre, ay 19. Ang mga order ng Mersenne matrice ay tumutugma sa pagkakasunud-sunod ng mga radioactive na elemento na tinatawag na actinium series: uranium 235, plutonium 239 (isang isotope na mas malakas na mapagkukunan ng atomic energy kaysa sa uranium), atbp. Ito rin ay mga alkali metal na lithium 7, sodium 23 at potassium 39.

Gallium – atomic weight 68
Mga order 4 k–2 Euler matrices (double Mersenne) ay tumutugma sa nitrogen 14 (ang batayan ng atmospera). Ang table salt ay nabuo ng dalawang "mersenne-like" na mga atomo ng sodium 23 at chlorine 35; magkasama ang kumbinasyong ito ay katangian ng Euler matrices. Ang mas malaking chlorine na may timbang na 35.4 ay mas mababa sa Hadamard na dimensyon 36. Mga kristal asin: cube (! i.e. tahimik na karakter, Hadamard) at octahedron (mas mapanghamon, ito ay walang alinlangan na si Euler).
Sa atomic physics, ang transition iron 56 - nickel 59 ay ang hangganan sa pagitan ng mga elemento na nagbibigay ng enerhiya sa panahon ng synthesis ng isang mas malaking nucleus ( H-bomba) at pagkabulok (uranium). Ang Order 58 ay sikat sa katotohanan na hindi lamang ito may mga analogue ng Hadamard matrice sa anyo ng mga Belevich matrice na may mga zero sa dayagonal, wala rin itong maraming weighted matrice - ang pinakamalapit na orthogonal W(58,53) ay may 5 mga zero sa bawat column at row (malalim na agwat ).
Sa serye na tumutugma sa mga Fermat matrice at ang kanilang mga pagpapalit ng order 4 k+1, sa pamamagitan ng kalooban ng kapalaran nagkakahalaga ito ng Fermium 257. Wala kang masasabi, isang eksaktong hit. Narito mayroong ginto 197. Copper 64 (63.547) at pilak 108 (107.868), mga simbolo ng electronics, hindi, tulad ng makikita, umabot sa ginto at tumutugma sa mas katamtamang Hadamard matrices. Ang tanso, na may atomic na timbang na hindi malayo sa 63, ay aktibo sa kemikal - ang mga berdeng oksido nito ay kilala.

Mga kristal ng boron sa ilalim ng mataas na paglaki
SA gintong ratio boron ay nakatali - ang atomic mass sa lahat ng iba pang mga elemento ay pinakamalapit sa 10 (mas tiyak na 10.8, ang kalapitan ng atomic na timbang sa mga kakaibang numero ay may epekto din). Ang Boron ay isang medyo kumplikadong elemento. Si Boron ay gumaganap ng isang masalimuot na papel sa kasaysayan ng buhay mismo. Ang istraktura ng balangkas sa mga istruktura nito ay mas kumplikado kaysa sa brilyante. Natatanging uri Ang kemikal na bono na nagpapahintulot sa boron na sumipsip ng anumang karumihan ay hindi gaanong nauunawaan, kahit na ang pananaliksik ay nauugnay dito malaking bilang ng natanggap na ng mga siyentipiko Mga Premyong Nobel. Ang hugis ng kristal ng boron ay isang icosahedron, na may limang tatsulok na bumubuo sa tuktok.
Ang misteryo ng Platinum. Ang ikalimang elemento ay, walang duda, ang mga marangal na metal tulad ng ginto. Superstructure sa Hadamard na sukat 4 k, 1 malaki.

Matatag na isotope uranium 238
Tandaan natin, gayunpaman, na ang mga numero ng Fermat ay bihira (ang pinakamalapit ay 257). Ang mga kristal ng katutubong ginto ay may hugis na malapit sa isang kubo, ngunit ang pentagram ay kumikinang din. Ang pinakamalapit na kapitbahay nito, ang platinum, isang marangal na metal, ay mas mababa sa 4 atomic weight ang layo mula sa ginto 197. Ang Platinum ay may atomic na timbang na hindi 193, ngunit bahagyang mas mataas, 194 (ang pagkakasunud-sunod ng mga Euler matrice). Ito ay isang maliit na bagay, ngunit dinadala siya nito sa kampo ng medyo mas agresibong mga elemento. Ito ay nagkakahalaga ng pag-alala, na may kaugnayan, na dahil sa kanyang inertness (ito ay natutunaw, marahil, sa aqua regia), ang platinum ay ginagamit bilang isang aktibong katalista para sa mga proseso ng kemikal.
Spongy platinum sa temperatura ng silid nag-aapoy ng hydrogen. Ang karakter ni Platinum ay hindi talaga mapayapa; ang iridium 192 (isang pinaghalong isotopes 191 at 193) ay kumikilos nang mas mapayapa. Ito ay mas katulad ng tanso, ngunit may bigat at katangian ng ginto.
Sa pagitan ng neon 20 at sodium 23 ay walang elementong may atomic weight 22. Siyempre, ang atomic weights ay mahalagang katangian. Ngunit kabilang sa mga isotopes, sa turn, mayroon ding isang kawili-wiling ugnayan ng mga katangian na may mga katangian ng mga numero at ang kaukulang matrice ng mga orthogonal na base. Ang pinakamalawak na ginagamit na nuclear fuel ay ang uranium 235 isotope (Mersenne matrix order), kung saan posible ang isang self-sustaining nuclear chain reaction. Sa kalikasan, ang elementong ito ay nangyayari sa matatag na anyo ng uranium 238 (Eulerian matrix order). Walang elementong may atomic weight 13. Kung tungkol sa kaguluhan, ang limitadong bilang ng mga stable na elemento ng periodic table at ang kahirapan sa paghahanap ng mga high-order level matrice dahil sa barrier na naobserbahan sa mga matrice ng ikalabintatlong order.

Isotopes ng mga elemento ng kemikal, isla ng katatagan
Ang Element 115 ng periodic table, moscovium, ay isang napakabigat na sintetikong elemento na may simbolo na Mc at atomic number 115. Ito ay unang nakuha noong 2003 ng magkasanib na pangkat ng mga Russian at American na siyentipiko sa Joint Institute for Nuclear Research (JINR) sa Dubna , Russia. Noong Disyembre 2015, kinilala ito bilang isa sa apat na bagong elemento ng Joint Working Group of International Scientific Organizations IUPAC/IUPAP. Noong Nobyembre 28, 2016, opisyal itong pinangalanan bilang parangal sa rehiyon ng Moscow, kung saan matatagpuan ang JINR.
Katangian
Ang Element 115 ng periodic table ay isang lubhang radioactive substance: ang pinaka-matatag na kilalang isotope nito, moscovium-290, ay may kalahating buhay na 0.8 segundo lamang. Inuri ng mga siyentipiko ang moscovium bilang isang non-transition metal, na may ilang mga katangian na katulad ng bismuth. Sa periodic table, nabibilang ito sa mga elemento ng transactinide ng p-block ng ika-7 panahon at inilalagay sa pangkat 15 bilang pinakamabigat na pnictogen (nitrogen subgroup element), bagaman hindi pa ito nakumpirmang kumikilos tulad ng mas mabibigat na homologue ng bismuth .
Ayon sa mga kalkulasyon, ang elemento ay may ilang mga katangian na katulad ng mas magaan na homologues: nitrogen, phosphorus, arsenic, antimony at bismuth. Kasabay nito, nagpapakita ito ng ilang makabuluhang pagkakaiba mula sa kanila. Sa ngayon, humigit-kumulang 100 moscovium atoms ang na-synthesize, na may mass number mula 287 hanggang 290.

Mga katangiang pisikal
Ang mga valence electron ng elemento 115 ng periodic table, moscovium, ay nahahati sa tatlong subshell: 7s (dalawang electron), 7p 1/2 (dalawang electron), at 7p 3/2 (isang electron). Ang unang dalawa sa kanila ay relativistically stabilized at, samakatuwid, kumikilos tulad ng mga marangal na gas, habang ang huli ay relativistically destabilized at madaling lumahok sa mga pakikipag-ugnayan ng kemikal. Kaya, ang pangunahing potensyal ng ionization ng moscovium ay dapat na mga 5.58 eV. Ayon sa mga kalkulasyon, ang moscovium ay dapat na isang siksik na metal dahil sa mataas na atomic na timbang nito na may density na humigit-kumulang 13.5 g/cm 3 .
Tinantyang mga katangian ng disenyo:
- Phase: solid.
- Natutunaw na punto: 400°C (670°K, 750°F).
- Boiling point: 1100°C (1400°K, 2000°F).
- Tukoy na init ng pagsasanib: 5.90-5.98 kJ/mol.
- Tiyak na init ng singaw at paghalay: 138 kJ/mol.

Mga katangian ng kemikal
Ang Element 115 ng periodic table ay pangatlo sa 7p series ng chemical elements at ito ang pinakamabigat na miyembro ng group 15 sa periodic table, na nasa ibaba ng bismuth. Ang kemikal na pakikipag-ugnayan ng moscovium sa isang may tubig na solusyon ay tinutukoy ng mga katangian ng Mc + at Mc 3+ ions. Ang dating ay malamang na madaling ma-hydrolyzed at bumubuo ng mga ionic bond na may mga halogens, cyanides at ammonia. Ang Muscovy(I) hydroxide (McOH), carbonate (Mc 2 CO 3), oxalate (Mc 2 C 2 O 4) at fluoride (McF) ay dapat na matunaw sa tubig. Ang sulfide (Mc 2 S) ay dapat na hindi matutunaw. Ang Chloride (McCl), bromide (McBr), iodide (McI) at thiocyanate (McSCN) ay bahagyang natutunaw na mga compound.
Ang Moscovium(III) fluoride (McF 3) at thiosonide (McS 3) ay maaaring hindi matutunaw sa tubig (katulad ng mga katumbas na bismuth compound). Habang ang chloride (III) (McCl 3), bromide (McBr 3) at iodide (McI 3) ay dapat na madaling matunaw at madaling ma-hydrolyzed upang bumuo ng oxohalides tulad ng McOCl at McOBr (katulad din ng bismuth). Ang Moscovium(I) at (III) oxides ay may magkatulad na estado ng oksihenasyon, at ang kanilang relatibong katatagan ay higit na nakasalalay sa kung aling mga elemento ang kanilang tinutugon.
Kawalang-katiyakan
Dahil sa ang katunayan na ang elemento 115 ng periodic table ay na-synthesize sa eksperimento nang isang beses lamang, ang mga eksaktong katangian nito ay may problema. Ang mga siyentipiko ay kailangang umasa sa mga teoretikal na kalkulasyon at ihambing sa higit pa matatag na elemento, katulad sa mga katangian.
Noong 2011, isinagawa ang mga eksperimento upang lumikha ng mga isotopes ng nihonium, flerovium at moscovium sa mga reaksyon sa pagitan ng "mga accelerator" (calcium-48) at "mga target" (american-243 at plutonium-244) upang pag-aralan ang kanilang mga katangian. Gayunpaman, ang mga "target" ay kasama ang mga impurities ng lead at bismuth at, samakatuwid, ang ilang mga isotopes ng bismuth at polonium ay nakuha sa mga reaksyon ng paglipat ng nucleon, na kumplikado sa eksperimento. Samantala, ang data na nakuha ay makakatulong sa mga siyentipiko sa hinaharap na pag-aaral nang mas detalyado ang mabibigat na homologue ng bismuth at polonium, tulad ng moscovium at livermorium.

Pagbubukas
Ang unang matagumpay na synthesis ng elemento 115 ng periodic table ay isang pinagsamang gawain ng mga siyentipikong Ruso at Amerikano noong Agosto 2003 sa JINR sa Dubna. Ang pangkat na pinamumunuan ng nuclear physicist na si Yuri Oganesyan, bilang karagdagan sa mga domestic specialist, ay kasama ang mga kasamahan mula sa Lawrence Livermore National Laboratory. Inilathala ng mga mananaliksik ang impormasyon sa Physical Review noong Pebrero 2, 2004 na binomba nila ang americium-243 ng calcium-48 ions sa U-400 cyclotron at nakakuha ng apat na atomo ng bagong substance (isang 287 Mc nucleus at tatlong 288 Mc nuclei). Ang mga atom na ito ay nabubulok (nabubulok) sa pamamagitan ng paglabas ng mga alpha particle sa elementong nihonium sa humigit-kumulang 100 millisecond. Dalawang mas mabibigat na isotopes ng moscovium, 289 Mc at 290 Mc, ang natuklasan noong 2009–2010.
Sa una, hindi maaprubahan ng IUPAC ang pagtuklas ng bagong elemento. Kinakailangan ang kumpirmasyon mula sa ibang mga mapagkukunan. Sa susunod na ilang taon, ang mga susunod na eksperimento ay higit pang nasuri, at ang paghahabol ng koponan ng Dubna na natuklasan ang elemento 115 ay muling iniharap.
Noong Agosto 2013, isang pangkat ng mga mananaliksik mula sa Lund University at sa Heavy Ion Institute sa Darmstadt (Germany) ang nag-anunsyo na inulit nila ang eksperimento noong 2004, na nagpapatunay sa mga resultang nakuha sa Dubna. Ang karagdagang kumpirmasyon ay inilathala ng isang pangkat ng mga siyentipiko na nagtatrabaho sa Berkeley noong 2015. Noong Disyembre 2015, isang pinagsamang grupong nagtatrabaho Kinilala ng IUPAC/IUPAP ang pagtuklas ng elementong ito at binigyan ng prayoridad ang pagtuklas sa pangkat ng mga mananaliksik ng Russia-Amerikano.

Pangalan
Noong 1979, ayon sa rekomendasyon ng IUPAC, napagpasyahan na pangalanan ang elemento 115 ng periodic table na "ununpentium" at tukuyin ito ng kaukulang simbolo na UUP. Bagama't ang pangalan ay mula noon ay malawakang ginagamit upang sumangguni sa hindi pa natuklasan (ngunit hinulaang ayon sa teorya) na elemento, hindi ito nakuha sa loob ng komunidad ng pisika. Kadalasan, ang sangkap ay tinawag sa ganoong paraan - elemento No. 115 o E115.
Noong Disyembre 30, 2015, ang pagtuklas ng isang bagong elemento ay kinilala ng International Union of Pure and Applied Chemistry. Ayon sa mga bagong patakaran, ang mga natuklasan ay may karapatang magmungkahi ng kanilang sariling pangalan para sa isang bagong sangkap. Noong una ay binalak na pangalanan ang elemento 115 ng periodic table na "langevinium" bilang parangal sa physicist na si Paul Langevin. Nang maglaon, ang isang pangkat ng mga siyentipiko mula sa Dubna, bilang isang pagpipilian, ay iminungkahi ang pangalang "Moscow" bilang parangal sa rehiyon ng Moscow, kung saan ginawa ang pagtuklas. Noong Hunyo 2016, inaprubahan ng IUPAC ang inisyatiba at opisyal na inaprubahan ang pangalang "moscovium" noong Nobyembre 28, 2016.